Рассмотрение процессов горения водорода и оксида углерода показывает сложность механизма реакции горения. В случае Н2 и СО реакция протекает как цепная с участием множества элементарных стадий и про-межуточных продуктов. Поэтому естественно ожидать, что механизм ре-акций горения более сложных по строению веществ — углеводородов еще более сложен и эффекты, сопровождающие процессы воспламенения и горения этих соединений более многообразны.
Имеющиеся в настоящее время сведения о природе химических превышений углеводородов в процессе их горения позволяют с некоторым приближением объяснить наблюдаемые эффекты.
Установлено, что в углеводородных пламенах, наряду с уже известными активными частицами ![]() , присутствует большое количество промежуточных продуктов более сложного строения. В ряде случаев они становятся источниками зарождения новых цепей. Основную роль в процессах воспламенения и горения углеводородов играют следующие типы промежуточных соединений:
, присутствует большое количество промежуточных продуктов более сложного строения. В ряде случаев они становятся источниками зарождения новых цепей. Основную роль в процессах воспламенения и горения углеводородов играют следующие типы промежуточных соединений:
43
Корольченко А. Я. Процессы горения и взрыва
1. Углеводородные радикалы, представляющие собой молекулу уг
леводорода, у которой удалены один или несколько атомов водорода. Эти
остатки называются алкилами (СНз — метил; С2Н5 — этил; С3Н7 — пропил и
т. д.). Из-за высокой реакционной способности алкилы в свободном виде
длительно не существуют. Присутствуют в пламенах в виде промежуточ
ных продуктов. При взаимодействии с другими молекулами ведут себя
как самостоятельная структурная группа. Углеводородные радикалы
обычно изображают буквой R.
2. Перекиси — соединения общей формулы R-00-R’.
3.Альдегиды — соединения типа
![]()
Простейшими альдегидами являются муравьиный (формальдегид) ![]() и уксусный (ацетальдегид)
и уксусный (ацетальдегид) ![]() . Эти вещества все-
. Эти вещества все-
Гда присутствуют в продуктах неполного сгорания углеводородов.
Зарождением цепи при горении углеводородов может стать любая реакция, в которой образуются углеводородные радикалы. Это может быть реакция разложения молекулы этана с образованием двух свободных метальных групп:
![]()
Или реакция углеводорода с кислородом:
![]()
Продолжение цепей происходит в результате реакций образования | перекисей или гидроперекиси:
![]()
Разветвление цепей осуществляется при разложении гидроперекиси:
![]()
![]()
44
Глава 2. Химические процессы при горении
Приведенная последовательность реакций приводит к постепенному увеличению в реагирующей системе концентрации перекисных соединений.
Одновременно с накоплением перекисей, радикалов ![]() И
И ![]() Начи-
Начи-
Нают идти параллельные реакции:
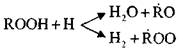
И
![]()
Эти реакции экзотермичны; при их протекании выделяется большое количество тепла.
При повышении температуры реагирующей смеси роль активных центров переходит от одних промежуточных продуктов к другим в следующем порядке: гидроперекиси алкилов, ацильные гидроперекиси, формальдегиды.
Экспериментальные исследования изменения состава реагирующей смеси во времени в высокотемпературной области (600-800°С) показывают, что процесс превращения исходных углеводородов в конечные продукты горения ![]() Иразделен
Иразделен ![]() на две стадии: на первой, протекающей с очень высокой скоростью, происходит окисление углеводородов до СО. На второй, медленной, стадии СО окисляется до
на две стадии: на первой, протекающей с очень высокой скоростью, происходит окисление углеводородов до СО. На второй, медленной, стадии СО окисляется до ![]() . Отсюда следует очень важный вывод: многие закономерности горения углеводородов могут быть объяснены особенностями горения оксида углерода.
. Отсюда следует очень важный вывод: многие закономерности горения углеводородов могут быть объяснены особенностями горения оксида углерода.



 2 мая, 2013
2 мая, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике