Конверсия прир и попутных газов – Высокотемпературная(кислородн и возд) и Каталитич(паровая и парокислородн). Один из осн способов получения водорода и смеси водорода с N, CO или N+CO в заданном отношении, к-е исп-ся в кач-ве сырья для пр-ва аммимка, метанола, синт спиртов, восстановит газов сред и защитн атмосфер. Наибольшее распространение получили методы высокотемпературн и катилитич конверсии прир газа. Синт газ: N+CO. Метана 88-99% в прир газе.
Хим р-и: (1) CH4+ 0,5O2=CO+2H2 + 35,6 кДж/моль, (2) CH4 + H2OПАР = СО + 3Н2 – 206,4, (3) СН4 + СО2 = 2СО +2Н2 – 248,3, (4) СО+ Н2О = СО2 +Н2 +43,6 При t >800 С т/д равновесие сдвинуто в сторону получения водорода и СО. CnHm – тяжел у/в в прир газе, они окисл-ся: (5) CnHm + 0,5O2 = nCO + 0,5mH2 , (6) CnHm + nH2OПАР = nCO + (n+0,5m)H2, Наличие избыточн водорода вызывает гидрирование высш водородов (7 и 8 – образование метана) (7) CnH2n+2+ (n–1)H2 = nCH4 , (8) CnH2n +nH2 = nCH4 , Еще идет образование сажи, если у/в не полностью сгорают. Негативные р-и образ-я сажи (тв углерода — сажистого) : (9) CH4=C+2H2 , (10) 2CO=C+CO2 . Образ-е сажи приводит к ум-ю актив-ти катализатора и к резкому снижению произв-ти реакторов конверсии. Высокотемпературная конверсия: (неполн горение в смеси с О2(или возд) в своб объеме без катализат) осн хим р-и проходят по ф-лам 1-4 и 5 при t=1350-1450 С, эта t достигается за счет подогрева исходн компонентов до t = 400-500 С (можно без печки в кот-утил подогреть). Сам проц идет в печке (1400 С с отопительным газом горение), чтобы метан пошел в р-и. Эта схема требует кислорода больше, чем по хим р-ям, поэтому в ходе конверсии обр-ся нек-е кол-во CO2 и водяных паров. Все схемы высокотемпер конв-и требуют тонкой очистви конвертируемых газов от сажистого углерода, к-й обр-ся по ур-ям 9-10. Синтез газ получают при давлении 30МПа, а горение прир газа при P ~ PАТМ. Тепловая схема конверсии с сатуратом-испарителем воды:
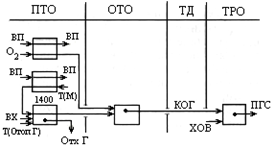 ВП – водяной пар, КОГ – конвертир отходящий газ, ХОВ – хим оч вода, ПГС – парогаз смесь. ДГ – дым газ, В – воздух, ОГ – отопит газ.
ВП – водяной пар, КОГ – конвертир отходящий газ, ХОВ – хим оч вода, ПГС – парогаз смесь. ДГ – дым газ, В – воздух, ОГ – отопит газ.
Принц сх ↑темпер конверсии прир газа с сатурацией конвертированного газа: 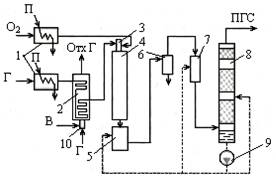
1 – паровые подогреватели, 2 – конвективно-радиационный подогреватель прир газа, 3 – горелка для сжигания газо-кислор смеси, 4 – конвертер прир газа, 5 – сатуратор-испаритель воды, 6 – циклонный сепаратор, 7 – турбулентный промыватель газов, 8 – скруббер, 9 – насос, 10 – горелка отопит газа. ОГ – отопит газ, В – воздух. В 5 газ насыщают парами, в 6 отделяют газ от тв частиц, в 7 ХОВ подают. Тепловая сх с котлом-утилизатором:
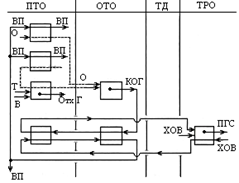
Принципиальная схема высокотемпературной конверсии природного газа с котлом утилизатором:
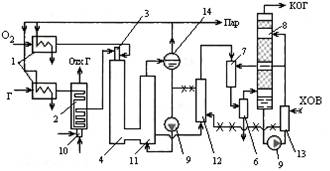
1 – паровые подогреватели, 2 – конвективно-радиационный подогреватель природного газа, 3 – горелка для сжигания газокислородной смеси, 4 – конвертер природного газа, 5 – сатуратор-испаритель воды, 6 – циклонный сепаратор, 7 – турбулентный промыватель газов, 8 – скруббер, 9 – насос, 10 – горелка отопит газа, 11 – котел-утилизатор, 12 – подогреватель химически очищенной воды, 13 – охладитель циркуляционной воды, 14 – барабан сепаратор пара.
При высокотемпературной конверсии предусматривается тонкая очистка конвертированных газов. Пар, полученный в кот-утил используется для предварительного подогрева природного газа и кислорода, а остальное кол-во потребляется технологическими аппаратами переработки конвертированного газа. Конвертер – камера неполного горения из углеродистой стали с внутренней трехслойной футировкой из корундового или высокоглиноземистого огнеупоров, шамота или изоляционного кирпича.
12.
Горение – проц взаимодействия топлива с окислителем, сопровождающийся выделением тепла, часто и света. Кинетическая и диффузная(смешение т+ок) обл-ти горения. 2 стадии – Воспламенение (период медленного окисления и накопления теплас постепенным повышением t) при достижении t воспламенения → Горение. Р-и при горении подразделяются на 2 типа – экзо — и эндотермические. Экзо – р-и идущие с выделением теплоты – окисление всех горючих эл-тов топлива О2, Н, S. Эндо – р-и с поглощением Q. Экзо :{С+O2 = СO2 , S+O2 = SO2 , 2H2+O2 = 2H2O } Эндо: {N2 +O2 = 2NO – 180, CO2 +C = 2CO – 7250 кДж } – балласт горит. Хим р-и подразделяются на гомогенные р-и, гетерогенные. Гомоген р-и – топливо и ок-ль в одном агрегатном состоянии. Гетерогенные – если в разных состояниях. Хим р-и обратимые(в прямом и обратном направлении идет) и необратимые. При горении топлива в котлах ск-ть прямого процесса много больше ск-ти обратимого. Считается, что горение необратимый процесс. Температура в центре факела 1500-2000 С. Термическая диссоциация при t центра факела = 1700 С. При t > 1700 С начинается процесс термической диссоциации, обратная р-я становится заметной и при этих t не возможно достичь полного окисления горючих эл-тов топлива (нет полного теплового эффекта горения). Чем ↑ t, тем меньше тепловыделение за счет прямого окисления топлива. Интенсивность горения хар-ся ск-ю хим р-и. Для гомоген р-и ск-ть – это массовое к-во газообр в-ва реагирующее в ед V в ед врем τ.
Для гетерогенной р-и – это масса в-ва топлива, реагирующего на единице пов-ти тв т в един вр τ. Скорость р-и зависит от t и концентрации реагир в-в. Скор-ть р-и подчиняется З-ну действующих масс: в однородной среде при пост t скорость р-и пропорциональна произведению концентрации реагирующих в-в. Для гомогенной р-и : mA+nB = dD — ωР-И = kCmACnB — произведение константы скорости р-и, определяется t и хим природой реагир в-в, CmA, CnB – концентрации реагирующих в-в в смеси. m, n – количество молей в-ва А и В. Прямо пропорционально парциальным давлениям А и В для газовой смеси(концентрации) : ωР-И = kРmAРnB, где Р – парциальные давления. Гетерогенные р-и : Ж+Г, Т+Г – концентрация горючего в-ва в процессе горения не меняется. Скорость гетерогенных р-й будет зависеть только от концентрации окислителя у поверхности контакта с горючим в-вом : ωР-И = kCпов-тиОК-ЛЬ, С – конц-я ок-ля у пов-ти. Зависимость k от t определяется З-ном Аррениуса: k = k0* E— ERT ![]() , k0 – предэкспотенциальный множитель, Т – темп, Е – энергия активации, R – универс газ пост.
, k0 – предэкспотенциальный множитель, Т – темп, Е – энергия активации, R – универс газ пост.
Активные молекулы – мол-лы, способные реагировать в данной хим р-и, обладающие эн-ей достаточной для разрушения внутримолекулярных связей исходных в-в – этот уровень эн-и наз-ся – Энергией активации. Скорость зависит от Т, Е и от концентрации горючего, ок-ля. Графически ск-ть хим р-и изобразим от t, E и С горюч. ωР-И = k0* E— ERT ![]() *Cпов-тиОК-ЛЬ,
*Cпов-тиОК-ЛЬ,
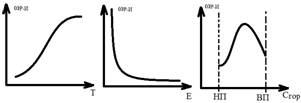
Мах ск-ть р-и достигается при определенном соотношении концентрации горюч и ок-ля. Эти соотношения в ф-ле хим р-и соответствуют мол массе и наз-ся Стехиометрическими. Ǝ нижн предел концентрации горючего НП – ниже к-го горение становится невозможным и ВП – после к-го ощущается нехватка окислителя для поддержания горения. Между НП и ВП – горение идет устойчиво. Рост ск-ти р-и с ↑t тормозится возможностью доставки в зону горения горючего и окислителя при турбулентном массообмене. T воспламенения – t горючей смеси, начиная с к-й смесь способна к самоускорению хим р-и до устойчивого горения.
Горючие соединения, входящие в состав любого топлива: углерод, водород и летучая сера. К балластным соединениям относятся: азот и кислород. Кроме того, в состав твёрдого топлива, жидких топлив, входят негорючие соединения, представляющие собой различные соединения оксидов алюминия, железа, кремния и т. д., которые в процессе горения претерпевают ряд физико-химических превращений и образуют золу и шлак.
Все составы топлив приводятся в таблицах. Для Твёрдых топлив В таблицах приводится рабочий состав топлива. Все расчёты, связанные с твёрдым топливом, выполняются на Рабочий состав. Газовое топливо в таблицах приводится в сухом состоянии. Расчёты по газовому топливу выполняются на Сухой состав.
Обозначения:
Горючие соединения: Углерод Ср (буква «р» в индексе обозначает «Рабочий состав»), Hp, Spk, Spор («ор» — органическая), Np, Op, Ap («А» — зольность топлива), Wp (влажность топлива). Такой состав называется «Рабочим составом топлива».
Если из рабочего состава убрать влагу, то получим «Сухой состав топлива».
Если из рабочего состава убрать влагу и зольность то получим «Горючий состав».
13.



 4 мая, 2013
4 мая, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике