При общении с потребителями мне нередко задают увлекательный вопрос — «Почему нужно страдать с газификацией твердого горючего, если схожий итог перевоплощения энергии горючего во что-то полезное (термическую либо механическую энергию) можно получить более ординарными процессами прямого сжигания либо пиролиза?»
Попробую ответить на этот вопрос, исходя из собственного осознания того, какой процесс и когда выгоден при различных исходных данных и разном хотимом итоге.
Для начала определимся в главных понятиях — что все-таки такое пиролиз, газификация и горение?
Для начала поглядим на хим состав разных жестких топлив. Понятное дело, под «твёрдыми» топливами предполагается органические горючего, а не всякая экзотика вроде железного натрия либо карбида:
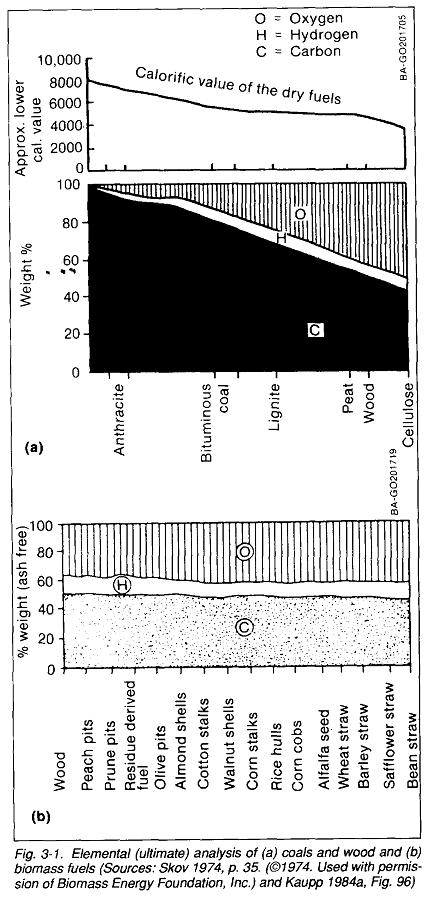
Как видно из приведенной рисунки — вполне на 100% «углеродных» топлив в природе — раз-два — и обчёлся. Даже уголь должен быть антрацитом, чтоб являться «практически» 100% углеродом (по факту антрацитом считается уголь с содерханием углерода более 96%). Уже в коксующихся углях толика углерода падает до 80%, в буром угле — до 65%, а в торфе вообщем может не превосходить 55%. Для дерева либо другой биомассы — другими словами не так давно еще «живой» материи — содержание углерода более-менее повсевременно (нижняя таблица) и находится на уровне около 50%.
Оставшиеся 50% в «живой» биомассе (45% в торфе, 35% в буром угле и 20% в коксующемся) именуются «летучими» и состоят из 2-ух главных частей — кислорода и водорода с маленькими примесями азота и других частей. Так как кислород является наисильнейшим окислителем — как «горючее» его использовать нереально — и, как следствие, калорийность твёрдых топлив резко падает с ростом толики летучих. При всем этом этот эффект наблюдается даже для 100% сухих топлив — 100% сухой древесный брикет будет в 2 раза наименее калорийным, чем 100% сухой антрацит — просто так как углерода там в 2 раза меньше!
Сейчас разглядим, какие процессы могут протекать в твёрдом горючем, исходя из наших познаний о его составе?
1. Процесс №1. Горение.
Легче всего показать процесс горения на примере незапятнанного угля (антрацита). Процесс горения антрацита может быть записан в общем виде, как
С + 02 = C02 + 97 650 ккал/кг-моль
По сути — процесс ращепления молекулы кислорода (O2), происходящий при больших температурах, вызволяет 2 атома кислорода, которые не должны вообще-то говоря прореагировать с одним и этим же атомом углерода и в серьезном виде формула горения распадается на две — другими словами процесс горения углерода идёт в два шага:
2С + О2 = 2СO + 58 860 ккал/кг-моль (это реакция образования угарного газа)
2СО + 02 = 2С02 + 38 790 ккал/кг-моль (а это реакция образования углекислого газа)
Если кислорода в подходящем потоке воздуха не много и уголь пылает при его недочете — то реакция образования углекислого газа нередко не успевает пройти полностью и отходящие газы состоят из консистенции угарного и углекислого газа. Следствием этого, непременно, является неполное высвобождение энергии горючего, что и употребляется для процессов газификации. Но об этом дальше.
2. Процесс №2. Пиролиз.
Процесс пиролиза идёт в той части горючего, которая является его «летучей» компонентой. На самом деле дела — это внедрение внутренних кислородных резервов горючего для его самоокисления (именуемых ещё сухой возгонкой). Конкретно очень неспешные процессы пиролиза и образуют из «живой» биомассы поочередно — торф, бурый уголь, коксующийся уголь а в конце процесса — антрацит.
В общем виде пиролиз может быть записан формулой:
СН 1.4 О 0.6 + 0.4 О2 = 0.7CO + 0.3 CO2 + 0.6H2 + 0.1 H20 — энергия
Резвый пиролиз биомассы начинается при температурах около 200С и предшествует горению углерода, которое начинается более-менее наблюдаемыми темпами только при 800-900С. Реакция пиролиза, в отличии от реакции горения, идёт с поглощением энергии (о чём свидетельствует член уравнения «минус энергия») и переводит летучие вещества твёрдого горючего в «поистине летучее» состояние — в горючие и негорючие газы.
В реальной жизни пиролиз очень связан с горением и очень нередко они взаимосвязаны в рамках одной непрерывной реакции:

К примеру, на этом фото нижняя «тусклая» часть пламени — это итог реакции пиролиза, а верхняя, ярко-жёлтая — итог реакции горения. Потому, кстати, сама спичка остаётся условно прохладной (около 400 С), в то время, как видимый язык пламени пиролизных газов может просто нагреться до 1500 С.
По факту в итоге пиролиза появляется, не считая обычных газов (угарный, углекислый, водяной пар, водород) очень огромное количество сложных органических соединений («смол»), которые отлично пылают, но беспощадно загрязняют трубы, вентиляторы, клапаны и внутренние поверхности хоть какого оборудования, если их не сжеть в «жарком» состоянии.
3. Процесс №3. Газификация.
Процесс газификации, как мы узрели при разъяснении процессов горения и пиролиза, уже незримо находится в любом варианте окисления горючего. По секрету скажу вам больше: водянистые горючего перед сгоранием тоже приходится газифицировать — конкретно тончайшее распыление дизельного горючего и бензина делает вероятным их горение в движках внутреннего сгорания. Только мощная поверхность реакции либо высочайшая температура может обеспечить устойчивое кислородное горение. По другому мы бы самовозгорались при хоть какой самой мельчайшей способности.
Неувязка процессов газификации, сопутствующих горению и пиролизу состоит конкретно в этом -образовавшиеся горючие газы так и норовят сразу сгореть в высокотемпературном пламени. Для того, чтоб этого не вышло — используют много ухищрений, но я обрисую только то, что употребляется в газификаторах обращённого процесса — восстановление угарного газа из углекислого на раскалённых углях.
Эта реакция может быть просто описана, как
СО2 + С = 2С0 — 38 790 ккал/кг-моль
Символ «минус» значит, что реакция идёт с поглощением тепла и потому и угли, и газы, участвующие в реакции, резко охлаждаются. Картина похожа на пиролиз в спичке — для газификации углём тратится энергия, получаемая из зоны кислородного горения в газификаторе. При низких температурах (ниже 600 С) продукты реакции (угарный и непрореагировавший с углём углекислый газ) размеренны и могут уже просто транспортироваться на маленькие расстояния без угрозы самовозгорания. В XIX веке многие городка в Европе освещались так именуемым «древесным» либо «угольным» газом, который представлял из себя конкретно такую смесь углекислого и угарного газов. Последние станции «угольного» газа, использовавшиеся в Великобритании для освещения маленьких городов, были закрыты посреди 1970-х годов, после открытия огромных припасов нефти в Северном море.
На данный момент эта разработка переживает 2-ое рождение в развивающихся странах, которые лишены доступа к дешевеньким газу и нефти:

Не считая реакции восстановления угарного газа на раскалённых углях идут ещё две реакции сотворения горючих газов:
H20 + C = H2 + CO
C0 + 3H2 = CH4 + H2O
В первой реакции появляется из воды появляется водород и угарный газ, а во 2-ой из угарного газа и водорода появляется метан. 2-ая реакция просит большего числа молекул и идёт обычно в разы медлительнее реацкий восстановления угарного газа и образования водорода.
Резюмируя вышеупомянутое, можно коротко обрисовать горение, пиролиз и газификацию так:
1. Горение. Продукты реакции негорючие, выделяется вся энергия горючего, реацкия экзотермическая, установки обыкновенные.
2. Пиролиз. Продукты реакции горючие, «грязные», энергия горючего отчасти перебегает в газ, реакция эндотермическая, установки легкие
3. Газификация. Продукты реакции горючие, «незапятнанные», энергия горючего перебегает в газ практически на сто процентов, реакция эндотермическая, установки сложные.



 27 августа, 2014
27 августа, 2014  Menedjer
Menedjer  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: