Углеводородовоздушных смесей
Законы термодинамики позволяют вычислить необходимые для описания процессов горения параметры: коэффициент расширения продуктов сгорания при начальных условиях ![]() Отношения теп-лоемкостей при постоянном давлении и постоянном объеме
Отношения теп-лоемкостей при постоянном давлении и постоянном объеме ![]() Как хтя свежей смеси, так и для продуктов сгорания; максимальное давление взрыва Ре; Адиабатическую температуру продуктов сгорания в изобарических и изохорических условиях, состав продуктов сгорания
Как хтя свежей смеси, так и для продуктов сгорания; максимальное давление взрыва Ре; Адиабатическую температуру продуктов сгорания в изобарических и изохорических условиях, состав продуктов сгорания
В настоящем разделе описан алгоритм расчета равновесного состояния продуктов сгорания C-H-0-N — содержащих горючих в воздухе в широком диапазоне начальных температур, давлений и концентраций, разработанный проф. В. В. Мольковым. Алгоритм основан на обобщении и систематизации термодинамических и математических методов с использованием наиболее точных данных по термодинамическим свойствам индивидуальных веществ.
Для повышения достоверности результатов в расчетах необходимо учитывать не только кислород и азот воздуха, но и другие входящие в его состав газы — ![]() , Н20, С02. Увеличение числа компонентов продуктов сгорания до 19 (Н2, Н20, С02, N2, Аг, С-газ, Н, О, N, CO, CH4, HCN, 02,
, Н20, С02. Увеличение числа компонентов продуктов сгорания до 19 (Н2, Н20, С02, N2, Аг, С-газ, Н, О, N, CO, CH4, HCN, 02,
![]() и проведение расчетов с учетом состава воз-
и проведение расчетов с учетом состава воз-
19
Корольченко А. Я. Процессы горения и взрыва
Духа средней влажности ![]()
![]() не усложняют вычислений на компьютере, использование которого позволяет существенно сократить время расчетов при одновременном повышении их точности в сравнении с приближенным подходом без использования компьютера.
не усложняют вычислений на компьютере, использование которого позволяет существенно сократить время расчетов при одновременном повышении их точности в сравнении с приближенным подходом без использования компьютера.
Брутто-реакция для сгорания горючего в воздухе средней влажности в расчете на моль свежей смеси может быть записана в виде
![]()
![]() (1.9)
(1.9)
Где ![]() — объемная концентрация горючего в свежей смеси:
— объемная концентрация горючего в свежей смеси: ![]() —
—
Число атомов соответственно углерода, водорода, кислорода и азота в молекуле горючего; ![]() — число молей
— число молей ![]() -го компонента продуктов сгорания;
-го компонента продуктов сгорания; ![]()
— ![]() -й Компонент продуктов сгорания.
-й Компонент продуктов сгорания.
Суммарное число атомов в системе, вычисленное по составу свежей смеси, равно
![]()
![]() (1-10)
(1-10)
Отношения числа атомов соответственно углерода, водорода, азота и аргона к числу атомов кислорода являются константами для конкретной смеси и не зависят от термодинамического состояния замкнутой системы:
![]() (1.11)
(1.11) ![]() (1.12)
(1.12)
![]() (1.13)
(1.13)
![]() (1.14)
(1.14)
— число атомов кислорода в системе.
20
Глава 1. Основные понятия теории горения
Для адиабатического процесса горения в изобарических условиях закон сохранения энергии эквивалентен закону сохранения энтальпии замкнутой системы
Hi = Hj, (1.15)
Где Н — энтальпия, а индексы ![]() И J Обозначают соответственно параметры свежей смеси и продуктов сгорания. Энтальпия моля свежей смеси
И J Обозначают соответственно параметры свежей смеси и продуктов сгорания. Энтальпия моля свежей смеси
![]() (1.16)
(1.16)
Где ![]() И
И ![]() — энтальпия соответственно горючего и воздуха при на-
— энтальпия соответственно горючего и воздуха при на-
Чальной температуре ![]() Зависимость энтальпии горючего и воздуха от начальной температуры в диапазоне от 250 до 500 К задается полиномом четвертой степени
Зависимость энтальпии горючего и воздуха от начальной температуры в диапазоне от 250 до 500 К задается полиномом четвертой степени
![]()
![]() <1.17)
<1.17)
Где ![]() (298) — энтальпия образования вещества при температуре 298 К;
(298) — энтальпия образования вещества при температуре 298 К;
![]() — энтальпия при температуре Т;
— энтальпия при температуре Т; ![]() — численные коэффициенты,
— численные коэффициенты,
Определяемые решением системы линейных уравнений, например, методом исключения Гаусса-Жордана; Т0 — Некоторое произвольное постоянное значение температуры.
Энтальпия продуктов сгорания, полученных при сжигании моля свежей смеси
|
|
(1.18)
Где Сумма в круглых скобках равна числу молей продуктов при сгорании одного моля свежей смеси; ![]() — мольная доля — го компонента продуктов сгорания;
— мольная доля — го компонента продуктов сгорания; ![]() — энтальпия
— энтальпия ![]() -го продукта
-го продукта ![]() Сгорания при темпера-
Сгорания при темпера-
Туре Т.
Значения энтальпий
![]() (1.19)
(1.19)
Определяются по зависимости приведенной энергии Гиббса от температуры Ф(Т) в диапазоне температур от 500 до 6000 К. Известно, что
21
Корольченко А. Я. Процессы горения и взрыва
|
|
(1.20)
При горении в изохорических условиях, например при взрыве газа в бомбе постоянного объема, переход системы из исходного равновесного термодинамического состояния в конечное происходит с сохранением внутренней энергии
![]() (1.21)
(1.21)
Где на моль свежей смеси ![]() (универсальная газовая постоянная
(универсальная газовая постоянная
R — 8,31441 Дж/моль • К), а для продуктов сгорания
|
|
(1.22)
Где Те — Равновесная температура продуктов сгорания в бомбе.
Давление взрыва газовой смеси в замкнутой бомбе определяется по отношению уравнений состояния идеального газа для продуктов сгорания и свежей смеси
![]() (1.23)
(1.23)
Для нахождения равновесного состава продуктов сгорания необходимо решить систему, включающую в себя 5 линейных (уравнения сохранения массы) и 14 нелинейных (уравнения химического равновесия) алгебраических уравнений.
Для изобарического процесса целесообразно записать уравнения сохранения массы через мольные доли продуктов сгорания ![]()
![]()
![]() (1.24)
(1.24)
![]()
![]() (1.25)
(1.25)
![]()
22
Глава 1. Основные понятия теории горения
|
|
(1.26)
|
|
(1.27)
|
|
(1.28)
Где значения ![]() Определены по параметрам свежей смеси в соот-
Определены по параметрам свежей смеси в соот-
Ветствии с формулами (1.10)-(1.14).
Сумма мольных долей по определению равна единице
![]() (1.29)
(1.29)
|
|
|
|
Число независимых уравнений химического равновесия равно разности числа компонентов продуктов сгорания и числа химических элементов в системе. В качестве независимых выбраны следующие четырнадцать реакций:
(1.30) (1.31) (1.32)
(1.33)
23
|
|
Корольченко А. Я. Процессы горения и взрыва
(1.34) (1.35) (1.36) (1.37) (1.38) (1.39) (1.40) (1.41) (1.42) (1.43)
Где Р — давление, при котором протекает реакция, атм. Зависимость констант химического равновесия ![]() От температуры принимается по справочным данным для реакций диссоциации
От температуры принимается по справочным данным для реакций диссоциации
|
|
(1.43 а)
24
Глава 1. Основные понятия теории горения
Где ![]() — стехиометрические коэффициенты, определяются из соотношения
— стехиометрические коэффициенты, определяются из соотношения
|
|
(1.44)
Котором ![]() — константа равновесияреакции
— константа равновесияреакции ![]() диссоциации (1.43 а)
диссоциации (1.43 а)
При температуре ![]() — приведенные энергии Гиббса соответ-
— приведенные энергии Гиббса соответ-
Ственно реагентов ![]() — тепловой эффект-ой
— тепловой эффект-ой ![]() реакции (1.44)
реакции (1.44)
При абсолютном нуле температуры.
Показатели адиабат для свежей смеси и продуктов сгорания определяются с использованием уравнения Майера по формуле
|
|
(1.45)
Где У — Показатель адиабаты; Ср — мольная теплоемкость при постоянном давлении; R — универсальная газовая постоянная. Теплоемкость смеси идеальных газов вычисляется по формуле
|
|
(1.46)
Для свежей смеси значения ![]() Определяются дифференцированием выражения (1.17) для энтальпии газов исходной смеси (горючего и воздуха) по температуре
Определяются дифференцированием выражения (1.17) для энтальпии газов исходной смеси (горючего и воздуха) по температуре ![]() Для продуктов сгорания — по выражениям, полученным в результате дифференцирования уравнения (1.19) по температуре Т.
Для продуктов сгорания — по выражениям, полученным в результате дифференцирования уравнения (1.19) по температуре Т.
При расчетах процессов горения в постоянном объеме константу равновесия ![]() Зависящую для идеального газа только от температуры,
Зависящую для идеального газа только от температуры,
При которой рассчитывается равновесие, и не зависящую от давления, целесообразно записать не через мольные доли ![]() Как это сделано при расчетах горения в изобарических условиях в уравнениях (1.30)-(1.43), а через количество молей П,. Тогда, например, для реакции (1.31) имеем
Как это сделано при расчетах горения в изобарических условиях в уравнениях (1.30)-(1.43), а через количество молей П,. Тогда, например, для реакции (1.31) имеем
|
|
(1.47)
Где Г-температура, при которой вычисляется константа равновесия; Р, И Г, — начальные значения давления и температуры свежей смеси. При пе-
25
Корольченко А. Я. Процессы горения и взрыва
Реходе от мольных долей к числу молей в изохорическом процессе в уравнениях сохранения массы (15)-(18) необходимо заменить значения ![]() На соответствующие
На соответствующие ![]() Уравнение (19) этом запишется в виде
Уравнение (19) этом запишется в виде
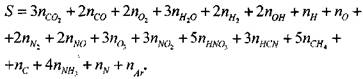 (1.48)
(1.48)
После умножения обеих частей уравнения (1.28) на можно вычислить сумму ![]() Необходимую для вычисления давлениявзрыва
Необходимую для вычисления давлениявзрыва ![]() газовой смеси в бомбе постоянного объема по уравнению (1.22).
газовой смеси в бомбе постоянного объема по уравнению (1.22).
Опишем метод решения системы уравнений (1.15), (1.23)-(1.43), содержащей 21 неизвестную величину: 19 мольных долей продуктов сгорания ![]() Суммарное число молей продуктов при сгорании моля свежей смеси
Суммарное число молей продуктов при сгорании моля свежей смеси ![]() И энтальпию продуктов сгорания
И энтальпию продуктов сгорания ![]() . В качестве независимых переменных выбраны мольные доли водорода, воды, диоксида углерода, азота и аргона
. В качестве независимых переменных выбраны мольные доли водорода, воды, диоксида углерода, азота и аргона ![]() Мольные
Мольные
Доли остальных 14 продуктов сгорания выражаются через константы равновесия и выбранные независимые переменные из уравнений (1.29)-(1.43). Далее перепишем уравнения (1.23)-(1.26) и (1.28) соответственно в виде
F(A, B, C, D,E) = 0,
G (А, В, С, D, Е) = 0,
H(A, B,C, D,.E) = 0, (1.49)
J (А, В, С, D, Е) = 0,
I (А, В, С, D, Е) = 0.
Линеаризовав систему уравнений (1.49) разложением в ряд Тейлора с точностью до членов, содержащих первые производные, получаем
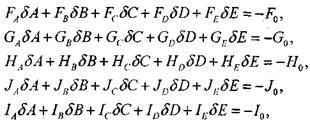 (1.50)
(1.50)
Где ![]() И т. д. (индекс 0 обозначает ис-
И т. д. (индекс 0 обозначает ис-
Ходные значения величин). Система уравнений (1.50) содержит пять неизвестных — ![]() Являющихся приращениями к исходным
Являющихся приращениями к исходным
26
Глава 1. Основные понятия теории горения
Вестных — ![]() Являющихся приращениями к исходным
Являющихся приращениями к исходным
Значениям мольных долей А, В, С, D, Е. Система может быть решена различными методами, например вычислением и делением друг на друга детерминантов соответствующих матриц системы уравнений (1.50) либо использованием метода исключения Гаусса-Жордана.
При предполагаемом значении равновесной температуры продуктов сгорания Т Вычисляют значения констант равновесия ![]() .. Затем определя-
.. Затем определя-
Ют по исходным значениям независимых переменных А, В, С, D, Е Значения остальных мольных, долей продуктов сгорания, а следовательно, и коэффициенты системы уравнений (1.50). Затем, решив эту систему уравнений, находят новые значения ![]()
Итерационный процесс повторяют до тех пор, пока абсолютные значения отношений ![]() Не станут меньше определенной величины, равной, например,
Не станут меньше определенной величины, равной, например, ![]() (при
(при ![]() Результаты расчетов практически не изменяются). Таким образом, определяют равновесный состав продуктов сгорания при предполагаемой температуре Т. По равновесному составу продуктов находят согласно уравнению (1.27) величину £и,-, что позволяет вычислять значения энтальпии Hj Продуктов сгорания по формуле (1.18).
Результаты расчетов практически не изменяются). Таким образом, определяют равновесный состав продуктов сгорания при предполагаемой температуре Т. По равновесному составу продуктов находят согласно уравнению (1.27) величину £и,-, что позволяет вычислять значения энтальпии Hj Продуктов сгорания по формуле (1.18).
При горении в изохорических условиях порядок вычислений аналогичен описанному выше. Отличие, как уже отмечалось, заключается в том, что расчет проводится не для мольных долей, а для числа молей и вместо энтальпий вычисляют внутреннюю энергию свежей смеси и продуктов сгорания.
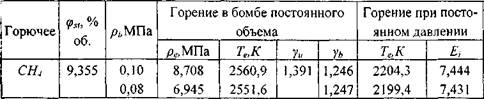
В табл. 1.1 приведены рассчитанные термодинамические параметры для стехиометрических смесей метана, пропана, гексана, гептана, ацетона, изопропилового спирта и бензола с воздухом.
Таблица 1.1. Максимальное адиабатическое давление взрыва в замкнутом сосуде ![]() , температура продуктов сгорания
, температура продуктов сгорания ![]() , показатели адиабат свежей смеси
, показатели адиабат свежей смеси ![]() и продуктов сгорания
и продуктов сгорания ![]() Коэффициент расширения продуктов сгорания при начальных условиях Ei Для стехиометрических углеводородных смесей при
Коэффициент расширения продуктов сгорания при начальных условиях Ei Для стехиометрических углеводородных смесей при
Начальной температуре ![]() = 298,15 К
= 298,15 К
27
Корольченко А. Я. Процессы горения и взрыва
|
0,06 0,04 |
5,188 3,439 |
2539,6 2521,9 |
1,247 1,248 |
2192,7 2183,2 |
7,412 7.385 |
|||
|
|
3,964 |
0,10 0,08 0,06 0,04 |
9,228 7,358 5,494 3,640 |
2604,4 2594,1 2580,5 2561,2 |
1,365 |
1,247 1,248 1,248 1,249 |
2245,2 2239,4 2231,7 2220,7 |
7,897 7,880 7,857 7,825 |
|
|
2,126 |
0,10 0,08 0,06 0,04 |
9,378 7,478 5,583 3,699 |
2611,6 2601,2 2587,3 2567,8 |
1,360 |
1,248 1,248 1,249 1,249 |
2251,7 2245,8 2237,9 2226,7 |
8,025 8,008 7,984 7,951 |
|
|
1,842 |
0,10 0,08 0,06 0,04 |
9,403 7,498 5,598 3,708 |
2613,0 2602,6 2588,7 2569,1 |
1,359 |
1,248 1,248 1,249 1,249 |
2253,0 2247,1 2239,1 2227,9 |
8,047 8,029 8,005 7,972 |
|
|
4,907 |
0,10 0,08 0,06 0,04 |
9,282 7,401 5,527 3,661 |
2594,2 2583,7 2570,4 2550,9 |
1,357 |
1,245 1,245 1,246 1,246 |
2242,1 2236,2 2228,2 2216,9 |
7,962 7,944 7,921 7,888 |
|
|
4,386 |
0,10 0,08 0,06 0,04 |
9,344 7,451 5,565 3,688 |
2574 3 2564,4 2551,8 2533,2 |
1,361 |
1,244 1,245 1,245 1,246 |
2219,7 2214,3 2206,9 2196,5 |
7,999 7,983 7,961 7,929 |
|
|
2,679 |
0,10 0,08 0,06 0,04 |
9,299 7,411 5,532 3,662 |
2678,2 2666,0 2650,6 2628,2 |
1,377 |
1,251 1,251 1,252 1,252 |
2321,1 2313,7 2304,2 2290,4 |
7,990 7,969 7,942 7,902 |
Стехиометрическая концентрация горючего при сгорании в воздухе средней влажности и в сухом воздухе определяются соответственно по формулам:
(1.51)
![]() (1.52)
(1.52)
Где ![]() — стехиометрический коэффициент кислорода, равный числу молей кислорода, приходящихся на 1 моль горючего вещества при его полном сгорании.
— стехиометрический коэффициент кислорода, равный числу молей кислорода, приходящихся на 1 моль горючего вещества при его полном сгорании.
28
Глава 1. Основные понятия теории горения
На Рис. 1.3 В качестве примера показано рассчитанное изменение температуры горения и мольных долей основных компонентов продуктов сгорания в зависимости от объемной концентрации горючего для гекса-но-воздушной смеси.
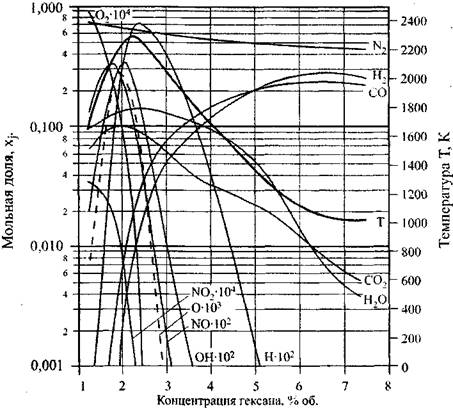
Рис. 1.3. Зависимость состава и температуры продуктов сгорания
Гексано-воздушной смеси при давлении 0,101 МПа и начальной температуре
298,15 К от концентрации гексана



 29 апреля, 2013
29 апреля, 2013  admin
admin 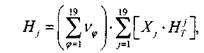
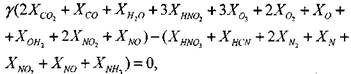
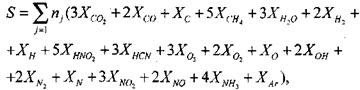
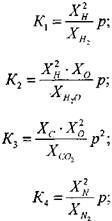
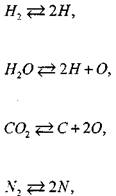
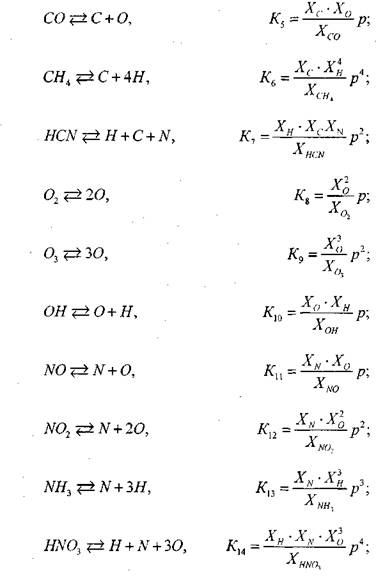
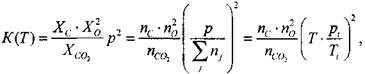
 Опубликовано в рубрике
Опубликовано в рубрике