Читальный зал
Гроссе Э., Вайсмантель X.
Химия для пытливых. Базы химии и занятные опыты.
Глава 4. Продолжение
УГОЛЬ — КОКС — СМОЛА — ГАЗ
Уголь в том состоянии, в каком он находится в природе, не годится для конкретного использования в хим индустрии. Его необходимо за ранее обустроить, превратив в как можно более незапятнанные углерод и углеводороды.
Один из самых больших потребителей угля — металлургия. В доменных печах уголь служит сразу топливом и восстановителем для оксидных руд. Но при использовании только-только добытого (так именуемого сырого) каменного либо бурого угля печи загрязнялись бы смолой. Потому ранее для выплавки чугуна применяли только очень незапятнанный древесный уголь. Только к началу XIX в. научились коксовать каменный уголь и использовать в доменном процессе получаемый кокс.
Хим индустрии для получения углеводородов и других органических соединений необходимы кокс, смола (побочный продукт коксования) и газы, получаемые при коксовании угля. Коксовые газы служат, не считая того, ценным горючим. Об этом свидетельствует, а именно, и наш ежедневный опыт использования, газа в быту.
Немецкая Демократическая Республика располагает очень обеспеченными припасами бурого угля, тогда как каменный уголь ей приходится большей частью брать за рубежом. Потому коксохимическая индустрия ГДР базирована, приемущественно, на переработке бурого угля.
Сырой бурый уголь содержит 45-55% воды. Он не годится на горючее, так как при его сжигании большая часть термический энергии никчемно расходуется на испарение воды. При высушивании на воздухе содержание воды в угле снижается до 15-20%, а брикеты бурого угля содержат воды еще меньше — от 10 до 18%. Сырой уголь поступает на переработку исключительно в виде брикетов.
В итоге сухой перегонки, другими словами при нагревании без доступа воздуха с улавливанием выделяющихся летучих веществ, брикеты преобразуются в кокс, смолу и газ.
Используются два метода таковой переработки бурого угля. 1-ый, более старенькый метод, при котором бурый уголь нагревают только до 500-600 °С именуется полукоксованием. При таких критериях ценные углеводороды улетучиваются. Остаток — полукокс — выходит недостаточно крепким и потому непригоден для металлургии. Его перерабатывают с целью получения углеводородов. В отличие от полукоксования, метод высокотемпературного коксования, разработанный химиками Билкенротом и Раммлером, позволяет создавать таковой кокс, который можно использовать для выплавки чугуна в особых низкошахтных печах.
Вместе с внедрением в металлургии буроугольный высокотемпературный кокс все обширнее используют в других отраслях индустрии в качестве ценного сырья и горючего.
Коксование каменного угля и высокотемпературное коксование бурого угля требуют температур порядка 1000 °С и поболее. Потому провести таковой опыт нам не получится. Но мы можем выполнить полукоксование бурого угля. Можно провести и сухую перегонку древесной породы, которая, хотя и ограниченно, но еще применяется в индустрии ГДР (В СССР в 70-е годы сухой перегонке (пиролизу) подвергалось около 7 млн м3 древесной породы в год, приемущественно с целью получения древесного угля и древесной смолы, при этом масштабы производства росли — Прим. перев.).
С нее мы и начнем, так как этот опыт проще. Не считая того, перегонка древесной породы позволит нам лучше разобраться в сути других, схожих с ней процессов.
ПОСТРОИМ УСТАНОВКУ ПОЛУКОКСОВАНИЯ
Сухую перегонку древесной породы и полукоксование бурого угля можно провести с очень малыми количествами веществ — даже в пробирке. Таким макаром, с основами процесса можно ознакомиться при наличии хотя бы самого обычного оборудования. В данном случае нам пригодится установка для перегонки.
Но, чтоб дистиллята хватило для предстоящей работы, сосуд для перегонки должен быть более 1 л. Таким макаром, сначала нам необходимо достать и приспособить для работы подходящий сосуд. Идеальнее всего подойдет железная реторта, которая возможно окажется в школьной хим лаборатории. Но можно использовать и хоть какой другой закрытый металлической сосуд — только бы в нем было отверстие, закрывающееся не очень большой пробкой. Годятся, к примеру, сварные сосуды из листового железа, мелкие газовые баллоны, не очень длинноватые обрезки труб с заваренным дном либо жестяные банки. Можно даже взять старенькый эмалированный кофейник. В крышке его нужно просверлить отверстие и подобрать к нему пробку. Не считая того, придется попросить сварщика наглухо приварить крышку к корпусу.
Если попытаться, наверное можно отыскать чего-нибудть подходящее посреди металлолома либо отходов механической мастерской. Возможно, в этом сумеют посодействовать и на том предприятии, где вы проходите производственную практику. 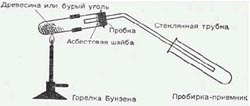
Подобранный сосуд перед первым опытом необходимо кропотливо отмыть жаркой водой, отскрести ершом и песком, потому что остатки бензина либо других горючих жидкостей могут во время опыта в один момент привести к пожару.
Чтоб избежать угрозы, сначала проверим сосуд на устойчивость к нагреванию. Сильным пламенем — на плите либо паяльной грелкой — нагреем его до красноватого каления (колер должен быть красным). Если после чего в сосуде не появится трещинок и плотность швов не нарушится, то он годится в качестве перегонного куба.
Потом подберем к отверстию сосуда подходящую пробку. В нее необходимо воткнуть стеклянную трубку, по которой будут отводиться летучие продукты перегонки. Пробка должна быть довольно устойчивой к высочайшей температуре. Сосуд типа баллона идеальнее всего закрыть резиновой пробкой, а нижнюю поверхность ее защитить от нагревания шайбой — железной либо из асбестового картона. В шайбе, естественно, должно быть отверстие для стеклянной трубки — того же поперечника, как и в пробке. Не считая того, чтоб защитить боковую поверхность, соприкасающуюся с раскаленным металлом, пробку необходимо обмотать узкой полосой из листового алюминия либо другого мягенького и устойчивого к нагреванию до 500 °С материала.
Если отверстие перегонного куба обширнее, чем у баллона, к примеру когда употребляется обрезок трубы, запаянный с 1-го конца, то можно закрыть его кропотливо подогнанной древесной пробкой конической формы. Такую пробку несложно сделать самому. Нижнюю поверхность ее тоже нужно защитить асбестовой шайбой, а боковую — обмоткой. Правда, одну и ту же древесную пробку получится использовать только пару раз. Перед каждым опытом ее придется подгонять к отверстию, осторожно постукивая по ней молотком. Стеклянную трубку необходимо уплотнить в отверстии древесной пробки при помощи куска резинового шланга.
Некие читатели, возможно, сумеют предложить и свои собственные усовершенствования. Но в любом случае нужно сначала проверить стопроцентно собранную установку, чтоб исключить возможность утечки горючих газов и паров в тех местах, где соединения недостаточно надежны. Для этого проведем «холостой опыт», т. е. опыт с пустым, не заполненным углем либо древесной породой перегонным кубом.
В качестве перегонного куба в последнем случае годится пробирка из тугоплавкого стекла, но ее можно нагревать только до 500 °С. Не считая того, после опыта пробирка так загрязнится, что ее чуть ли получится отлично отмыть.
Сейчас нам пригодится мощнейший источник тепла, позволяющий подогреть куб до требуемой температуры. Процесс осуществляется вполне только при температуре около 500 °С, другими словами при нагревании железа до красноватого каления. В последнем случае можно нагревать до 350-400 °С, но при всем этом процесс происходит только отчасти. Тепла, которое дает рядовая горелка Бунзена, для этого не хватит, так как оно расходуется на всю относительно огромную поверхность перегонного куба.
Металлической сосуд вместимостью около 1 л можно довести до требуемой температуры хотя бы в нижней его части методом долгого нагревания на кухонной газовой плите как можно более сильным пламенем. Можно нагревать и паяльной горелкой — сначала при стопроцентно открытом подводе газа без подачи воздуха, а потом огромным пламенем при умеренной поступлении воздуха.
В конце концов, подойдет и плита, которую топят углем. В данном случае тоже нужно очень нагревать сосуд конкретно нагим пламенем.
Если сосудом для полукоксования служит стеклянная пробирка, то рекомендуется поставить ее в огромную кастрюлю, дно которой покрыто слоем песка высотой около 1 см. Тогда пробирка не должна разбиться.
В качестве холодильника идеальнее всего взять обычную, не очень узкую стеклянную трубку, плотно обвитую спиралью из узкой свинцовой трубки. Через свинцовый змеевик во время опыта необходимо безпрерывно пропускать воду.
Ни холодильник Либиха (прямой), ни шариковый холодильник использовать в установке для полукоксования не стоит: они так очень загрязнятся, что их позже не отмыть. По той же причине в качестве приемника возьмем не очень дорогую широкогорлую коническую пробирку (пробирку Эрленмейера) либо молочную бутылку на 250 мл. Закроем приемник резиновой пробкой с 2-мя отверстиями. В одно из их должна заходить охлаждаемая стеклянная трубка, выходящая из перегонного куба. В другое отверстие вставим более узкую, скрученную под прямым углом стеклянную трубку для отвода горючих газов и паров.
Приемник поместим в баню, через которую во время опыта будем всегда пропускать прохладную воду. Сейчас, когда все изготовления окончены — для этого, очевидно, пришлось потрудиться — приступим к первому опыту.
Сухая перегонка древесной породы
Наилучшая древесная смола выходит из как можно более сухой бамбуковой древесной породы. Из других лиственных пород образуются более либо наименее подобные продукты, тогда как древесная порода хвойных пород из-за высочайшего содержания в ней природной смолы дает при перегонке смолу несколько другого состава.
Идеальнее всего нам получится воспроизвести перегонку бамбуковой древесной породы в индустрии, если мы возьмем кропотливо высушенные кусочки дерева из старенькой мебели. Попробуем, к примеру, использовать для этой цели остатки старенького прабабушкиного комода, который отец только-только разломал и выкинул.
Кусочек дерева измельчим — расколем и распилим его на кубики с длиной ребра около 1 см либо щепки размером 1,5-2 см — и заполним ими собственный перегонный куб.
Сейчас соберем установку и включим нагрев и остывание. Уже через достаточно маленький просвет времени, осторожно вдыхая пары, мы почувствуем на выходе из трубки для отвода газа специфичный запах паленой древесной породы. Этот запах, пожалуй, нельзя именовать противным. Скоро в приемнике возникают 1-ые капли дистиллята. Из отводной трубки выходят только газы — в главном, диоксид углерода (углекислый газ) и метан.
Если поднести к отверстию этой трубки пылающую спичку, их можно поджечь. В предстоящем коксовые газы будут всегда пылать сами светящимся пламенем. Так как они имеют сильный запах и содержат диоксид углерода, помещение нужно всегда отлично проветривать.
Перегонка занимает более часа. В конце опыта необходимо нагревать очень очень, чтоб древесная порода обуглилась на сто процентов. В это время отгоняется, в главном, древесная смола, образующая в приемнике белоснежный дым. Дистиллят расслаивается на коричневатую водную жидкость в смолу. Когда перегонка закончится, закончим опыт. Перегонный куб откроем только после остывания, так как очень подогретый древесный уголь при соприкосновении с воздухом просто самовоспламеняется.
Из 100 г древесной породы выходит около 35 г древесного угля и 45 мл дистиллята, а остальная часть древесной породы преобразуется в газы.
Разотрем древесный уголь в порошок и насыплем в склянку. Он еще понадобится нам для обесцвечивания смесей. Конкретно так его употребляют и в индустрии, сначала в производстве сахара.
Из дистиллята выделим древесную смолу (деготь). Для этого после отстаивания осторожно отделим и отфильтруем аква слой. При испытании лакмусовой бумажкой он обнаруживает сильнокислую реакцию. Это разъясняется присутствием в нем 10-12 % уксусной кислоты. Вот поэтому приобретенное вещество именуют древесным уксусом. Не считая того, в нем содержатся метанол — от 2 до 4 %, маленькое количество ацетона (пропанона) и другие вещества.
Состав древесной смолы очень сложен. Она находит различное применение, к примеру, ею смолят лодки и пропитывают древесную породу (жд шпалы, древесные бруски для покрытия проезжей части мостов и т. д.) с целью защиты от тления.
Перегонкой можно поделить древесную смолу на жидкое креозотовое масло и древесный выпекал, которые тоже употребляются в народном хозяйстве. К примеру, колбасы при обработке парами креозота «коптятся» и тем предохраняются от порчи.
Березовый деготь служит для пропитки натуральной кожи и присваивает ей типичный запах.
Для предстоящей переработки нальем древесный уксус в пробирку и соединим ее с дефлегматором. В верхнее отверстие дефлегматора вставим указатель температуры для измерения температуры паров, а отводную трубку соединим с холодильником, нужным для конденсации паров. Можно взять холодильник Либиха либо опять стеклянную трубку с внешним свинцовым змеевиком. Осторожно нагреем пробирку на водяной бане. Приемником сначала может служить малая пробирка.
При 80-85 °С медлительно отгоняется несколько капель прозрачной воды. Она состоит в большей степени из ядовитого метанола, который бурлит уже при 64,7 °С, малого количества ацетона и других веществ. Плотно закроем пробирку пробкой — приобретенный «древесный спирт» нам еще пригодится.
Когда при 85 °С ничего уже больше не отгоняется, уберем водяную баню и остаток в пробирке на асбестированной сетке нагреем горелкой Бунзена до кипения. Через некое время отгоняется вода и уксусная кислота, а растворенные в древесном уксусе составные части смолы (оксибензолы, креозот) остаются.
Когда отгонится примерно три четверти воды, закончим перегонку. К дистилляту будем понемногу добавлять известь до того времени, пока он не закончит окрашивать лакмусовую бумажку в красноватый цвет. При всем этом известь реагирует с уксусной кислотой с образованием отлично растворимого этаната (ацетата) кальция, другими словами кальциевой соли уксусной кислоты.
Раствор профильтруем и осторожно упарим до получения упомянутой соли в виде сероватого порошка. Очень очень нагревать нельзя, так как по другому этанат кальция заблаговременно разложится. В технике эту соль именуют сероватым древесноуксусным порошком. Сохраним этанат кальция и позже используем его для получения уксусной кислоты и ацетона. Кто не желает за ранее перегонять древесный уксус, может сходу нейтрализовать его известью и упарить. В данном случае приобретенный порошок будет достаточно очень загрязнен оксибензолами.
В индустрии уксусную кислоту на данный момент уже не выделяют обходным методом через ее кальциевую соль, а конкретно извлекают органическими растворителями, которые не смешиваются с водой. При встряхивании с таким растворителем уксусная кислота из аква раствора перебегает в слой добавленного растворителя.
Полукоксование бурого угля
В последующем опыте заполним сосуд для коксования кусками бурого угля размером в горошину — для этого нужно измельчить брикеты. По способности будем нагревать еще посильнее, чем при сухой перегонке древесной породы. В остальном же опыт стопроцентно сходен с предшествующим.
Скоро появится соответствующий запах коксующегося угля. Так же как и в прошлом опыте, газы можно поначалу поджечь, а позже они будут пылать сами.
Вместе с метаном, диоксидом углерода и аммиаком (в присутствии аммиака можно убедиться при помощи стеклянной палочки, за ранее погруженной в концентрированную соляную кислоту) они содержат маленькое количество ядовитого оксида углерода.
В приемнике собирается коричневатая жидкость — подсмольная вода, коричневато-черная смола и сырой парафин. Последний осаждается на стенах приемника желто-коричневатым слоем. Из 250 г бурого угля выходит 15-25 г смолы и сырого парафина и около 40 мл подсмольной воды.
Сосуд для коксования мы и сейчас откроем только когда он совершенно остынет, чтоб предупредить вероятное самовоспламенение. В сосуде остается так именуемый буроугольный полукокс.
Как мы уже знаем, в отличие от каменноугольного кокса и буроугольного высокотемпературного кокса, он хрупок и потому не годится для выплавки чугуна. Но это потрясающее горючее, применяемое в особых печах для отопления помещений, также на электрических станциях.
Не считая того, в газогенераторах Винклера из него получают газы, используемые в хим синтезе и в качестве горючего.
Дистиллят при помощи декантации разделим на подсмольную воду и смесь смолы с парафином, которую можно выскрести ложкой.
В подсмольной воде, которую мы используем для последующих опытов, содержатся, сначала, оксибензолы. Добавив к ней двойной объем этанола (годится и денатурат), можно в значимой мере отделить оксибензолы, потому что они, в отличие от углеводородов, отлично растворяются в спирте. В оставшейся мягенькой массе вместе с маленьким количество спирта содержатся, в главном, водянистые и твердые углеводороды парафинового ряда (алканы).
Фракционированной перегонкой из нее можно получить бензин, среднее масло, мягенький и жесткий парафин. Можно использовать эту смесь и без подготовительного разделения. Позже мы будем окислять ее с целью получения жирных кислот.
Итак, как мы уже удостоверились, полукоксование и коксование бурого угля при высочайшей температуре дают горючие газы, смолу и полукокс либо, соответственно, высокотемпературный кокс.
Невзирая на большие объемы современных коксовых печей, коксовых газов очевидно не хватает для того, чтоб вполне обеспечить горючим газом индустрия. Потому на многих предприятиях, где перерабатывается уголь, из него в итоге неполного окисления получают так именуемый воздушный, либо генераторный газ:
C + 1/2O2 = CO; Q = 122,67 кДж
Этот газ, который, очевидно, содержит и неизмененный азот воздуха, потом сжигают:
CO + 1/2O2 = CO2; Q = 283,45 кДж
Неполное сгорание угля с образованием оксида углерода — «угарного газа», СО — независимо от нашего желания всегда может происходить в хоть какой печи, если она не впору закрыта. Угарный газ очень ядовит, отравление им приводит к злосчастным случаям.
В индустрии сырой бурый уголь либо полукокс газифицируют в больших газогенераторах. В наши деньки для этого используются аппараты непрерывного деяния.
В той зоне газогенератора, куда подается воздух, сначала уголь сгорает стопроцентно с образованием диоксида углерода СО2.
В расположенном выше слое угля, нагретом сверх 1000 °С, СО2 вследствие недочета кислорода восстанавливается до СО. Весь процесс в целом происходит самопроизвольно, потому что неполное сгорание углерода по приведенному выше уравнению тоже осуществляется с выделением тепла. Этого тепла довольно для того, чтоб поддерживалась требуемая высочайшая температура угля.
Напротив, образование водяного газа просит дополнительного подвода тепла. Водяной газ появляется при действии водяного пара на раскаленный уголь:
C + H2O = CO + H2; Q =-221,06 кДж
Водяной газ в текущее время делается тоже, в главном, на установках непрерывного деяния, при этом благодаря подаче незапятнанного кислорода часть угля сгорает, так что общий термический эффект положителен.
Водяной газ — это смесь оксида углерода с водородом, которая может содержать и диоксид углерода. Для обыденного отопления водяной газ очень дорог. Ввиду высочайшей теплоты сгорания его используют для получения очень больших температур (для сварки), также в качестве ценной добавки к бытовому газу.
Водяной газ служит одним из важных видов сырья в промышленном органическом синтезе. В качестве так именуемого синтез-газа он применяется для получения бензина и метанола. Не считая того, из водяного газа получают водород для синтеза аммиака.
КАРБИД ВСЕ ЕЩЕ НУЖЕН
Все мы знакомы с карбидом кальция. При действии воды он образует горючий газ, применяемый для так именуемой автогенной сварки. В былые времена газовые лампы, заряженные карбидом, использовались в велосипедных фонарях и даже в байках и автомобилях. На данный момент такие лампы стали музейными экспонатами.
Формула карбида кальция — СаС2. Он появляется из негашеной извести и кокса при температуре порядка 2000 °С:
CaO + 3C = CaC2 +CO
Получение карбида кальция
В хим кружке при наличии малеханькой электродуговой печи, также требуемого источника тока можно получить мало карбида кальция. В небольшой графитовый тигель либо в углубление, выдолбленное в толстом угольном электроде, поместим смесь равных (по массе) количеств оксида кальция (негашеной извести) и кусочков кокса размером с булавочную головку. Лишний уголь при действии кислорода воздуха сгорит. Схема опыта показана на рисунке. 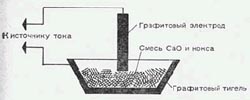
Верхний электрод приведем в соприкосновение со консистенцией, создавая электронную дугу. Смесь проводит ток благодаря кускам угля. Пусть дуга пылает 20-30 минут при самом большом вероятном токе. Глаза необходимо защитить от броского света очками с очень темными стеклами (очки для сварки).
После остывания смесь преобразуется в расплав, который, если опыт прошел удачно, содержит мелкие куски карбида. Чтоб проверить это, полученную массу поместим в воду и соберем образующиеся пузырьки газа в пробирке, перевернутой ввысь дном и заполненной водой.
Если же электродуговой печи в лаборатории нет, то просто можно получить газ из имеющегося в продаже карбида кальция. Заполним газом несколько пробирок — на сто процентов, наполовину, на одну третья часть и т. д. Заполнять газом более широкие сосуды, к примеру стаканы, нельзя, так как вода вытечет из их, и в стаканах получатся консистенции газа с воздухом. При их воспламенении, обычно, происходит сильный взрыв.
Карбид кальция ведет взаимодействие с водой по уравнению:
CaC2 + 2H2O = Ca(OH)2 +C2H2
Вместе с гидроксидом кальция (гашеной известью) эта реакция приводит к образованию этина — ненасыщенного углеводорода с тройной связью. Благодаря этой связи этин проявляет высшую обскурантистскую способность.
Исследование этина
Докажем присутствие в этине (ацетилене) ненасыщенной связи при помощи реактива Байера либо бромной воды.
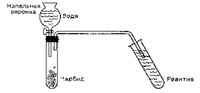
Для этого поместим реактив в пробирку и пропустим через него этин. Его мы получим в другой пробирке из нескольких кусочков карбида кальция. Эту пробирку закроем резиновой пробкой с 2-мя отверстиями. В одно из их заблаговременно вставим стеклянную трубку с изогнутым концом — он должен быть погружен в пробирку с реактивом. В другое отверстие вставим капельную воронку и кран ее сначала закроем.
Можно взять заместо нее и ординарную стеклянную воронку, заменив кран зажимом, как при получении метана. В воронку нальем воду и, осторожно приоткрывая кран, будем медлительно, по каплям, добавлять ее к карбиду.
Ввиду взрывоопасности этина проведем опыт поблизости от открытого окна либо в вытяжном шкафу. Вокруг ни при каких обстоятельствах не должно быть открытого пламени либо включенных нагревательных устройств.
Этин в чистом состоянии представляет собой газ со немного пьянящим запахом. Этин, приобретенный из технического карбида, всегда загрязнен неприятно пахнущими ядовитыми примесями фосфористого водорода (фосфина) и мышьяковистого водорода (арсина). Консистенции этина с воздухом, содержащие от 3 до 70% этина, взрывоопасны. Этин совсем не сложно растворяется в ацетоне. В виде такового раствора его можно хранить и перевозить в железных баллонах. (Незапятнанный этин практически не обладает запахом. Консистенции его с воздухом взрываются от искры в более широком интервале концентраций этина — от 2,3 до 80,7%. — Прим. перев.).
Этин можно перевоплотить в очень многие соединения, которые, а именно, заполучили огромное значение для производства пластмасс, синтетического каучука, фармацевтических средств и растворителей. К примеру, при присоединении к этину хлористого водорода появляется винилхлорид (хлористый винил) — начальное вещество для получения поливинилхлорида (ПВХ) и пластмасс на его базе. Из этина же получают этаналь, с которым мы еще познакомимся, а из него — многие другие продукты.
В ГДР самым большим производителем и сразу потребителем этина является комбинат синтетического бутадиенового каучука в Шкопау. Почта 90% из 400 товаров этого огромного предприятия выходит стопроцентно либо отчасти из этина. Не считая того, огромные количества карбида кальция выпускают азотный завод в Пистерице и химический завод в Гиршфельде.
В 1936 г. на местности, где сейчас находится ГДР, выполнялось 206000 т карбида. В 1946 г. создание снизилось до 30000 т, но уже в 1951 г. повысилось до 678 000 т, а в 1955 г. превысило 800 000 т. С 1972 г. только упомянутый комбинат синтетического каучука получает раз в год более 1 млн. т. карбида.
Эти числа свидетельствуют об большущем значении карбида кальция и связанных с ним процессов.
В дальнейшем разработка, основанная на применении карбида, станет больше вытесняться более прибыльным нефтехимическим созданием, сделанным в ГДР в Шведте и Лёйне-2. Основным недосгатком карбидного способа получения этина является только большой расход электроэнергии. По правде, на комбинате в Щкопау только одна современная карбидная печь «съедает» от 35 до 50 мегаватт. А ведь там работают целые батареи таких печей! На создание карбида кальция в ГДР тратится более 10% всей добываемой электроэнергии.
Читать поначалу >>>
|| Содержание книжки ||
Читать далее >>>
Читальный зал кунсткамеры: что здесь есть?



 27 августа, 2014
27 августа, 2014  Generator
Generator  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: