Взаимодействие оксида углерода с кислородом представляет собой важнейшую для процессов горения реакцию. Протекание этой реакции во
40
__________________________ Глава 2. Химические процессЫ при горении
Многих случаях определяет закономерности горения углеродсодержащих веществ. Для реакции характерен разветвленный цепной механизм. Она отличается рядом особенностей.
Длительное время существовало убеждение, что абсолютно сухая смесь СО и 02 не может воспламеняться и гореть. Однако тщательно поставленные опыты, в которых отсутствие воды контролировалось с помощью масс-спектрографа, показали, что воспламенение возможно и для сухой смеси. При этом следует отметить, что присутствие в системе СО + 02 паров воды или водорода активизирует процесс воспламенения и горения за счет увеличения количества возможных активных центров. Ускоряющее действие воды особенно заметно при малых ее концентрациях.
Горение оксида углерода в присутствии паров воды или небольших добавок водорода происходит с участием следующих элементарных процессов:

Радикалы, Н02, образующиеся по реакции (VI), могут продолжать цепь (реакция VIII) или приводить к ее обрыву по реакция (IX—XII).
Для оценки условия перехода медленного окисления СО в цепной взрыв оценим вероятность обрыва цепи через радикал Н02; при этом учтем, что роль реакций (X) и (XI) в обрыве цепи будет несущественной по
41
Сравнению с реакцией (IX), поскольку константы скоростей процессов (IX-XI) при температурах порядка 1000К близки между собой, но концентрации радикалов ![]() и
и ![]() значительно меньше концентрации атомов водорода, поскольку радикалы
значительно меньше концентрации атомов водорода, поскольку радикалы ![]() и
и ![]() Обладают большей химической активностью. Поэтому вероятность
Обладают большей химической активностью. Поэтому вероятность ![]() Обрыва цепи через радикал Н02 может быть записана в виде:
Обрыва цепи через радикал Н02 может быть записана в виде:
|
|
(2.6)
Где ![]() — константы скоростей соответствующих реакций.
— константы скоростей соответствующих реакций.
При дальнейшем анализе будем рассматривать лишь систему реакций (I—VII), считая реакцию (VI) обрывом цепи с эффективной константой скорости ![]() Присутствие множителя 2 в этом выражении обу-
Присутствие множителя 2 в этом выражении обу-
Словлено тем, что в результате протекания последовательных процессов (VI) и (IX) происходит гибель двух активных центров-атомов Н. Исходя из этого, получено следующее условие перехода окисления СО в цепной взрыв:
|
|
(2.7)
![]()
При температуре 1000К
Поэтому при условии, когда
![]()
Или
![]()
Влияние величины
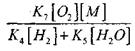
На решение уравнения (2.7) будет слабым.
42.
Глава 2. Химические процессы при горении
В случае ![]() Или
Или ![]() (что наблюдается в
(что наблюдается в
Реальных пламенах СО), уравнение (2.7) преобразуется к виду:
![]() (2.8)
(2.8)
Таким образом, условие горения оксида углерода в воздухе в значительной степени определяется присутствием и закономерностями горения водорода. Окисление СО по реакции (I) зависит от концентрации радикалов ОН, образующихся в реакциях с участием водорода.
Особенность реакции горения оксида углерода заключается в ее резвом торможении при введении в реагирующую систему малых добавок веществ, обладающих высоким сродством к атомам водорода. Такими веществами, ингибирующими горение СО, являются галоиды и галоиди-роизводные углеводородов. Их ингибирующее действие обусловлено обрывом реакционных цепей при взаимодействии с атомами водорода по реакции
![]()



 2 мая, 2013
2 мая, 2013  admin
admin 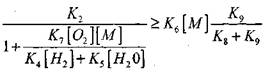
 Опубликовано в рубрике
Опубликовано в рубрике