На основании закона действующих масс скорость изотермической мономолекулярной реакции в каждый момент пропорциональна концентрации реагента в тот же момент, т. е.
|
(5-27) |
В формуле:
С а — начальная концентрация реагирующего вещества;
Х — число молей, прореагировавших в единице объема за время т.
Интегрируя выражение. (5-27), получаем:
1п(Са—х)=—&т + const. (5-28)
Константа интегрирования определяется из уравнения (5-28). При условии т = 0, х=0 получаем:
In CA=const.
Подстановка ее в (5-28) после несложных преобразований дает уравнение для количества образующихся продуктов реакции в виде:
Х=СА( 1-е-*’). (5-29) >
Полученный экспоненциальный закон расходования исходного вещества и соответственно образования продукта реакции типичен для
Всех простых реакций, причем чем выше порядок реакции, тем медлен
|
Рис. 5-4. Нарастание концентрации продуктов реакции во времени. 1 — для молекулярной; 2 — бимолекулярной и 3 — три — молекулярной реакции. |
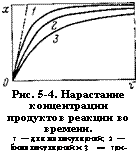 Нее происходит образование веществ (рис. 5-4): концентрация продуктов реакции сначала увеличивается быстро, (затем все медленнее, асимптотически стремясь к максимуму в конце процесса.
Нее происходит образование веществ (рис. 5-4): концентрация продуктов реакции сначала увеличивается быстро, (затем все медленнее, асимптотически стремясь к максимуму в конце процесса.
Скорость реакции в каждый момент определяется наклоном кривой в соответствующей точке (рис. 5-4). Наклон кривой, а следовательно, и скорость изотермической реакции имеет наибольшее значение в начале реакции, затем уменьшается пропорционально действующей концентрации. Аналогично изменяется скорость реакций более высокого порядка, с увеличением порядка реакции скорость ее падает, а время превращения соответственно увеличивается.
Обратимые реакции являются сложными реакциями. В них одновременно протекает несколько не зависящих друг от друга реакций, каждая из которых подчиняется закону действующих масс. В обратимых реакциях при постоянной температуре наибольшая скорость также соответствует начальному моменту времени и падает по мере протекания реакции вследствие уменьшения концентраций исходных веществ.



 7 апреля, 2013
7 апреля, 2013  doctype
doctype  Опубликовано в рубрике
Опубликовано в рубрике