Угольные частицы очень малых размеров (пылинки), находясь в потоке, приобретают скорость, практически равную или мало отличающуюся от скорости движения газов. Последнее означает, что газы обтекают частицу с небольшой скоростью. При малых относительных скоростях, когда вынужденный конвективный перенос отсутствует, можно считать, что горение мелких частиц в потоке происходит равномерно, величина концентрации кислорода по всей поверхности частицы одинакова.
Процесс химического реагирования частицы, обтекаемой потоком с малой скоростью, Л. Н. Хитриным представлен схемой, изображенной на рис. 15-4,«. Основным (первичным) процессом считается реагирование углерода с кислородом, поступающим к поверхности частицы из окружающего пространства за счет движения среды и диффузии, с об
разованием окиси углерода и углекислоты. Продукты сгорания покидают частицу, направляясь в окружающее пространство.
Дальнейшее состояние окислов зависит от условий протекания процесса и в особенности от температуры.
При сравнительно невысоких температурах или повышенных скоростях обтекания образующаяся окись углерода может быть вынесена в окружающую среду (комплекс /). При более высоких температурах окись углерода может вступить во вторичную реакцию и сгореть, потребляя часть кислорода, поступающего к поверхности частицы («ом — плеск Г). Углекислота может частично возвратиться на поверхность частицы и в случае достаточной температуры — выше 1200—1300°С вступить во вторичную реакцию с углеродом, образуя окись углерода (комплекс //). При очень высокой температуре процесс восстановления СО2 может протекать настолько быстро, что во вторичном реагировании будет образовываться такое количество окиси углерода, которое, сгорая, будет потреблять все количество кислорода до поступления его к частице. В этом случае кислород не будет достигать поверхности частицы и основным процессом станет реагирование углерода с углекислотой (комплекс //’)•
В случае омывания частиц потоком с большой скоростью с лобовой стороны могут протекать только гетерогенные процессы / и II’ (рис.. 15-4,6). Процесс догорания окиси углерода удаляется от частицы и протекает на границе циркуляционной зоны в кормовой части потока (комплекс III). Процесс восстановления (комплекс IV) может идти с лобовой стороны, но главным образом протекает в тыльной части, где кислород отсутствует. При высоких температурах его интенсивность повышается и выгорание тыльной стороны частицы становится заметным.
При температурах порядка 900—1300°С можно считать, что осуществляются только процессы I и III, пространственно отделенные друг от друга.
Если в процессе горения углерод реагировал бы только с кислородом с образованием окиси углерода и углекислоты, которые не вступали бы во вторичное реагирование, а отводились в окружающее пространство, то в стационарных условиях скорость горения равнялась бы величине диффузионного потока кислорода, поступающего в единицу времени к единице поверхности.
Приравнивая количество кислорода, расходуемого на реагирование с углеродом, к его количеству, поступающему диффузией, получаем зависимость для удельной скорости горения углерода по расходу кислорода от интенсивности диффузионных процессов г кислоро
Да/(см2-с), по типу уравнения (15-3), а именно:
.1С" — (15-23)
А и ^
При этом предполагается, что скорость реагирования углерода с кислородом пропорциональна концентрации кислорода у поверхности* т. е. реакция первого порядка. Внутреннее реагирование учтено заменой константы скорости реакции & коэффициентом реакционного газообмена а.
Количество углерода, которое может газифицироваться при потреблении кислорода, зависит от состава образующихся окислов, т. е. от отношения С0/С02. Если обозначить через р отношение массы газифици
Рованного углерода к массе израсходованного кислорода, то при потреблении кислорода в количестве /С°а с единицы поверхности частицы будет газифицировано углерода в количестве
|
(15-24) |
—+—
А ад
Которое называют удельной поверхностной скоростью горения углерода.
Величина р может изменяться от значения 0,375, соответствующего случаю расходования кислорода только на С02, до значения 0,75, соответствующего случаю расходования кислорода только на СО. В этих пределах величина /Ссв также меняется вдвое, причем наибольшая скорость расходования углерода получается при максимальном выходе окиси углерода.
Таким образом, стехиометрический коэффициент р характеризует распределение кислорода на образование окислов, а следовательно, и эффективность расходования кислорода при его реагировании с углеродом.
Для определения диффузионных потоков можно исходить из тождественности переноса вещества переносу тепла. Величина ад как аналог коэффициента теплоотдачи может быть заимствована из экспериментальных закономерностей по теплообмену тел аналогичной формы с газовой средой.
При малых скоростях обтекания сферических частиц, когда концентрация кислорода у стенки по всей поверхности практически одинакова, аналогично тепловому критерию Нуссельта используется диффузионный критерий Нуссельта:
В формуле:
<1 (2Я) —диаметр сферической частицы;
/) — коэффициент молекулярной диффузии.
|
С, |
![]() Подстановка значения ад, определенного из уравнения (15-25), в выражение (15-24) дает общее выражение для удельной скорости горения углерода:
Подстановка значения ад, определенного из уравнения (15-25), в выражение (15-24) дает общее выражение для удельной скорости горения углерода:
|
|
(15-26)
|
|
А
При этом Ыид = /:(Не) и выражает зависимость скорости реакции от гидродинамических свойств окружающей среды.
Для определения удельной скорости горения углерода по формуле (15-26) необходимо знать температуру частицы и газовой среды, концентрацию газовых реагентов и размер частицы, которые в процессе горения изменяются и являются искомыми величинами. Поэтому Л. Н. Хитри — ным были даны упрощенные выражения для некоторых типичных температурных областей при естественной диффузии.
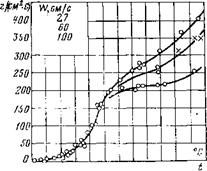
Для сопоставления полученных закономерностей с опытом Л. Н. Хитриным было исследовано горение частицы кокса антрацита диаметром 15 мм, результаты которого представлены на рис. 15-5 в виде зависимости КС8—[(Т).
В области низких температур, где скорость химической реакции мала и расходуемое на реагирование количество кислорода значительно меньше его количества, которое может быть доставлено диффузией, т. е. где
|
900 600 800 /ООО 1200 /Ш |
![]()
|
Рис. 15-5. Зависимость скорости горения антрацита от температуры по опытам Л. Н. Хитрина с сотрудниками. На графике верхняя кривая 100, средняя — 60, нижняя — 27 см/с; по оси ординат /СС„. |
|
1 |
![]() 1
1
>
ДИф
|
(15-27) |
![]() И отсутствует горение СО: КС3 = (ЗаС0.
И отсутствует горение СО: КС3 = (ЗаС0.
Изменение Кс
А, который сильно зависит от температуры, поэтому эту область называют кинетической областью окислительных реакций.
Верхний предел применимости формулы для расчета скорости горения в кинетической области Л. Н. Хитриным определяется условием:
|
(15-28) |
![]() А <0,05 4-*
А <0,05 4-*
А
С повышением температуры взаимодействие кислорода с углеродом
1 / 1
Ускоряется и при некоторой температуре, когда — < —^———————— > удель-
|
N11 |
![]() О2
О2
Диф
|
Ная скорость горения углерода |
|
К, |
|
Стремится к пределу ОСо£> |
|
Диф’ |
|
N11 |
|
|
Который ограничивается диффузионной способностью среды по кислороду. Так как ^и°*ф = /(Не), то скорость горения зависит от скорости потока и диаметра частицы. С уменьшением размера частицы и увеличением скорости обтекания Ксв увеличивается. Влияние температуры мало и определяется зависимостью от нее С0 и /). Поскольку скорость горения практически не зависит от реакционных свойств топлива и температуры, а ограничивается скоростью диффузии кислорода, этот режим называется диффузионным.
При горении мелких частиц окислы углерода и летучие быстро выносятся в поток интенсивно протекающими процессами молекулярного и молярного переноса. В результате этого при их малой концентрации окисление окиси углерода и летучих в пограничном слое частицы не происходит. Поэтому для мелких частиц в области температур порядка 1500—1700°С величина р практически не изменяется и характеризует соотношение окислов в первичном реагировании.
В случае, если горенке окиси углерода интенсифицируется при отсутствии восстановления СО2, Р стремится к значению 0,375, а удельная скорость горения— к величине
1 о п п ^
При этом образуется только углекислота. Этот режим соответствует диффузионной области окислительных реакций, которая наступает при температурах порядка 1000°С в зависимости от условий диффузии и свойств угля.
Экспериментальными исследованиями получено, что
МиДИф = 2 (1 + 0,08Ие2/3). (15-31)
При малых скоростях обтекания, до чисел Ие<100, с достаточной точностью в формуле (15-30) может быть принято Ыид = 2, что дает:
(15-32)
При крупных частицах в области температур порядка 750°С в результате сгорания СО р уменьшается. В области температур, в которой еще восстановления СОг не происходит, для крупных частиц при малой скорости обтекания величина |3 также может быть принята постоянной и равной 0,375—0,4.
Как видно из рис. 15-5, в области низких температур процесс протекает в кинетической области, с повышением температуры скорость реакции резко возрастает. При температурах 700—800°С рост скорости горения замедляется диффузионным торможением. В зоне достаточно высоких температур процесс переходит в диффузионную область окислительных реакций, где скорость горения практически не зависит от температуры, а определяется интенсивностью диффузионного подвода кислорода, достигающего предельного значения при данных условиях процесса. Чем больше скорость дутья, тем при более высокой температуре процесс переходит в диффузионную область. При этих температурах (1000—1100°С) начинает значительно ускоряться процесс восстановления углекислоты и с повышением температуры быстро прогрессирует, в результате чего удельная скорость горения начинает с ростом температуры увеличиваться. Предел увеличения Ксв из-за интенсификации восстановления углекислоты экспериментально еще не определен.
Предполагается, что этот предел наступает при дальнейшем повышении температуры, когда процесс переходит в диффузионную область реакции восстановления углекислоты, в которой = 24/32, а удельная скорость горения равна:
(15’33)
При этом образуется только СО и отсутствует объемное горение.
Рассмотренный в настоящей главе материал положен в основу приводимого в гл. 16 исследования динамики и расчета горения одиночных частиц с учетом реальных топочных условий.



 19 апреля, 2013
19 апреля, 2013  doctype
doctype  Опубликовано в рубрике
Опубликовано в рубрике