Теоретическая температура горения £теор отличается от жаропроизводительности £тах гем, что при подсчете ор учитывается теплота диссоциации продуктов горения. При высокой температуре С02 диссоциирует с образованием СО и 02, а Н20 — с образованием Н2 и 02.
Степень диссоциации возрастает с повышением температуры и снижением парциального давления С02 и II20.
Так, при парциальном давлении С02 0,2 ата, при сжигании углерода при атмосферном давлении в стехиометрическом объеме воздуха и содержании в продуктах сгорания 20% С0.2, при 1800° диссоциирует около 3,7% С02, при 1900° — около 6%, при 2000° — около 10%, при 2100° — около 15%, при 2200° — около 23%.
Таким образом, с повышением температуры диссоциация С02 быстро возрастает, и при 3000° диссоциирует около 90% С02.
При понижении парциального давления С02 степень диссоциации возрастает. Так, например, при 2000° и давлении С02 1 ата диссоциирует около 6% двуокиси углерода, при давлении С0.2 0,2 ата диссоциирует около 10% и при давлении 0,1 ата — около 12,5%.
Водяной пар диссоциирует при равных температурах и давлениях в значительно меньшей степени, чем двуокись углерода. Так, при 2000° и парциальном давлении 1 ата диссоциирует около 2% Н20, при давлении
0, 2 ата — около 3,5% и при давлении 0,1 ата — около 4%.
Таким образом, степень диссоциации водяного пара при температуре 2000° примерно втрое меньше степени диссоциации двуокиси углерода.
При подсчете температуры в топках при сжигании топлива с высокой жа — ропроизводительностыо, и в особенности при подогреве воздуха, необходимо считаться с понижением температуры вследствие диссоциации продуктов сгорания.
Методика подсчета температуры горепия с учетом диссоциации продуктов сгорания была разработана акад. П. С. Курнаковым и получила широкое применение в расчетах металлургических процессов [47] и процессов горения. Метод подсчета в большой степени осложняется необходимостью учета изменения вследствие диссоциации двух величин — температуры и объема продуктов горения.
Следует отметить, что при высокой температуре необходимо считаться не только с диссоциацией двуокиси углерода с образованием окиси углерода и кислорода и диссоциацией водяного пара с образованием водорода и кислорода, но и с более далеко идущей диссоциацией продуктов горения с образованием гидроксилов и атомарного водорода и кислорода, а также с появлением в составе продуктов горения окиси азота N0 в результате эндотермического процесса окисления азота. Так, подсчеты состава цродуктоп сгорания при атмосферном давлении октана (С8Н18) в стехиометрическом объеме воздуха, произведенные Я. Б. Зельдовичем и Л. И. Полярним, показали, что при 2127° (2400°К) в составе продуктов горения содержится 72,1 % N2; 12,61%НаО; 9,88% С02; 2,31 % СО; 1,14% ОН:0,41% N0:0,92?« 02, 0,12% Н и 0,09% О 148].
Таким образом, трудоемкий подсчет теоретической температуры горения, производимый по указанной выше методике [47], не вполне точен, поскольку учитывается только диссоциация С02 и Н20 с образованием СО, Н2 и 02 и не принимается во внимание содержание в продуктах горения гидроксилов и атомарных газов. Допускаемая при этом погрешность может быть оценена следующим образом. Теплота диссоциации в пересчете па 1 нм3 исходных продуктов сгорания октана равна 101 ккал с учетом образования СО, Н, и 02 и около 108 ккал с учетом образования также закиси азота, гидроксилов и атомарных газов.
Следовательно, расхождение составляет около 7 ккал на 1 нм3 продуктов горения, или около 450 ккал на 1 нмя октана.
Указанная величина составляет около 0,8% по отношению к теплоте сгорания октана. Температура горения, подсчитанная без учета более глубокой диссоциации продуктов горепия при указанной температуре, также будет примерно на 0,8%, или на 15°, отличаться от температуры горения, подсчитанной с более полным учетом продуктов ;|,иссоциации.
Теоретическая и расчетная температуры горения в большой степени зависят от точности заданного соотношения топлива и воздуха. Так, при увеличении избытка подаваемого воздуха на 1 % расчетная температура горения снижается примерно на 0,5%. Между тем контроль процесса горения, осуществляемый по газовому анализу, в большинстве случаев не позволяет поддерживать избыток воздуха с точностью, превышающей 1 %, что соответствует изменению содержания кислорода в продуктах горепия около 0,2%.
В связи с этим следует считаться с определенными погрешностями в подсчете теоретической и расчетной температур горения, производимом по принятой в настоящее время сложной и трудоемкой методике.
Как уже отмечалось, в технических расчетах при сжигании топлива без ирименения обогащенного кислородом воздуха и при поддержании температуры ниже 2100° обычно считаются с образованием в продуктах сгорания в результате диссоциации только СО, Н2 и О.,. В этих случаях с учетом указанных выше погрешностей можно приближенно подсчитать теоретическую и расчетную температуры горения по простой методике, основанной на следующих положениях.
Объем продуктов сгорания в результате диссоциации С02 и Н20 возрастает, однако теплосодержание продуктов сгорания, не диссоциированных и частично диссоциированных, при той же температуре практически почти не меняется вследствие того, что объемная теплоемкость исходных трехатомных газов С02 и Н20 более высока по сравнению с теплоемкостями образующихся двухатомных газов. Так, объемная теплоемкость С02 от 0 до 2000° равна 0,5785 ккал/нм3, теплоемкость СО — 0,3592 ккал/нм3 и теплоемкость кислорода 0,3748 ккал/нм3 (см. табл. 24). Следовательно, теплосодержание 1 нм3 СО И 0,5 НМ302, образующихся в результат© диссоциации ^ имя СО-2, мало от-
Личастся от теплосодержания исходной С0.2
Г-со + 0,5С’о. = 0,3592 + 0,5-0,3748 = 0.546(5 ккал/нм3 С02°С.
По отношению к теплосодержанию исходной С02 разность составляет
Теплосодержание продуктов диссоциации 1 нмг Н20 в большей степени отличается от теплосодержания исходного водяного пара
^д“00 = 0,4688 ккал-пм* СС;
0,3362 +0,5-0,3748 = 0,5236 ккал’нм* Н20°С;
„ (0.5**36—0,4688)-100
Н, и ————— 11%.
Итак, теплосодержание продуктов диссоциации С02 несколько ниже теплосодержания исходной двуокиси углерода, а теплосодержание продуктов диссоциации Н20 выше, чем у исходного водяного пара.
С учетом того обстоятельства, что С0.2 диссоциирует в сопоставимых условиях в большей степени, чем водяной пар, суммарные отклонения в теплосодержании продуктов диссоциации и исходных газов у большинства видов топлива в значительной степени нивелируются.
Поскольку при температурах до 2100° диссоциирует лишь малая часть С02 п Н20 и, следовательно, еще меньшая часть суммарного объема продуктов сгорания топлива, содержащих высокий процент азота, можно для упрощенного подсчета теоретической и расчетной температур горения принять, что произведение объемов продуктов сгорания на их средневзвешенную теплоемкость в температурном интервале от 0° до £теор не меняется в результате диссоциации С02 и ИХ) [6].
При таком допущении теоретическая температура горения может быть подсчитана по формуле
1 __ — ^дигг. /Т-„. оч
‘теор — у.(] "
Где (3„ — низшая теплота сгорания топлива, ккал/кг или ккал/нм3’,
С. ш.-г — теплота диссоциации продуктов сгорания, образующихся при сгорании 1 кг или 1 нм3 топлива, ккал/кг или ккал/нм3;
V — объем продуктов сгорания, нм3/кг или нмя/нм3;
С средневзвешенная теплоемкость продуктов сгорания от 0° до <теор икал/нм3, °С.
1 Значения средневзвешенной теплоемкости продуктов сгорания от 0° до t приведены в табл. 24.
Следовательно, упрощенный подсчет теоретической температуры горения /;г()[, отличается от подсчета жаропроизводительности <тах лишь необходимостью учета теплоты диссоциации <Здиес.
Данные о степени диссоциации С02 и Н30 при различных температурах и парциальных давлениях приведены в табл. 32, 33.
В качестве примера приводим подсчет теоретической температуры горения пропана.
Низшая теплота сгорлппя пропана 21 800 ккал/нмя. Уравнение горения пропана в стехиометрическом объеме воздуха
СзП3 + 502 + 5-3,Тем? — ЗС02 + 4ЧгО + 18,81’2.
Объем продуктов сгорания 25,8 им3.
Состав продуктов сгорания СО, — 11,5%; Н20 — 15,5%; 1Ч2 — 73,0%.
Задаемся температурой горения 2000° и подсчитываем значение теплоты диссоциации СО., и Н40 при парциальпых давлениях 0,115 и 0,155 ата и температуре 2000° Степень диссоциации СО, а — 0,12 (табл. 32).
Теплота диссоциации С02:
С. = ГСО/а<?СО =3.0,12-3030 = 1090 «««.
Степень диссоциации Н20 6 = 0,036 (табл. 33).
|
Таблица 32 Степень диссоциации двуокиси углерода а, */
|
Таблица ЯЗ
Стенонь диссоциации водяного пара, б %
|
Парциальное давление водяного пара, ата
|
|
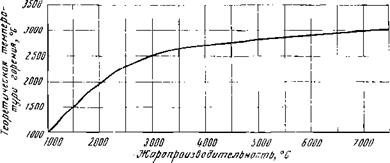
Рис. 14. Соотношение жаропроиз- нодительностп и теоретической тем- |
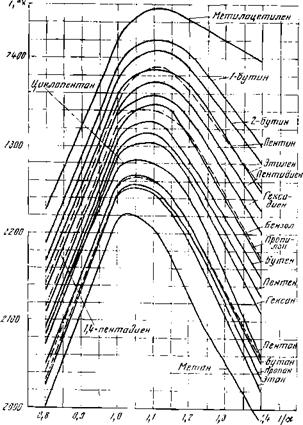
![]() Рис. 13. Соотношение теоретических и расчетных температур горения углеводородом
Рис. 13. Соотношение теоретических и расчетных температур горения углеводородом
Теплота диссоциации Н20:
С = Кнг0’б<?нг = 4-0,36-580 = 370 ккал.
Суммарная теплота диссоциации:
?дисс = ?дисс + = 1090 + 370 = 1450 “ЙЛ-
Теоретическая температура горения:
— Сдисс 21800—14^0 ^ Г7- = 1970° С ^ 2240° К.
Теор УС 25,8-0,4 —
Для сопоставления на рис. 13 приведены значения теоретической температуры горения при атмосферном давлении различных углеводородов. Значение теоретической температуры горения (при а = 1) пропана равно около
Подсчитанная аналогичным образом по упрощенной методике теоретическая температура горения метана равна 1930° С, или — 2200° К.
Значение теоретической температуры горения метана по графику, приведенному на рис. 13, равно 2220° К. Теоретическая температура горения бензола, подсчитанная по формуле (IX. 8), равна 2060°С, или около 2330°К и мало отличается от температуры, приведенной на указанном графике (2340 К).
Таким образом, для определения теоретической температуры горения, развиваемой в условиях сжигания топлива в воздухе (до 2Ш0°С), можно пользоваться с достаточной для технических расчетов степенью точности простой методикой подсчета 16].
При £Шах порядка 2200еС /т(.ор £1П.1Т-0,93, а при <Г111к порядка 2100~С <гсо„ = /тах-0,94 [49].
Необходимо отмстить, что при сжигании топлива в кислороде или обогащенном кислородом воздухе при температурах значительно более высоких необходимо подсчитывать температуру горения с учетом образования сложной гаммы продуктов диссоциации. В этих случаях различие между теоретической температурой горения и жаропроизводительностью, подсчитываемой без учета диссоциации, очень велико, как это видно из графика (рис. 14).
Теоретическую температуру горения, подсчитанную при сжигании в абсолютно сухом воздухе, обозначают а при учете содержания в воздухе
1 "о влаги по массе /теч,.
Различие между Гт-. и 1се0р — около 30° trcol■, = t^:!^Q]i —30е



 13 июня, 2013
13 июня, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике