|
Г |
Орение в горючих смесях может возникнуть в результате их самовоспламенения, зажигания внешним источником или самовозгорания. Если процессы самовоспламенения и зажигания характерны для веществ, находящихся в газообразном, жидком или твердом состоянии, то самовозгорание характерно для твердых материалов (особенно находящихся в мелкораздробленном состоянии) или высококипящих жидкостей, распределенных на материалах с развитой поверхностью.
3.1. Самовоспламенение. Стационарная теория
Стационарная теория самовоспламенения (теория теплового взрыва) объясняет наличие критических условий самовоспламенения. В этой теории рассматривается стационарное в тепловом отношении состоящие реагирующей системы «горючее вещество — окислитель», при котором теп-лоотвод от системы равен тепловыделению. Теория позволяет определить условия достижения критического состояния. При этом для решения задачи используется модель реакции нулевого порядка, характеризующаяся отсутствием расходования в процессе реагирования исходных продуктов.
Тепловая теория самовоспламенения разработана академиком Н. Н. Семеновым. Она заключается в следующем. Предположим, в сосуде объемом V Находится горючая смесь. Температура стенок сосуда поддерживается постоянной и равна Т0. При температуре смеси Т В ней будет протекать химическая реакция со скоростью ![]() , подчиняющаяся закону Арре-ниуса:
, подчиняющаяся закону Арре-ниуса:
![]() (3.1)
(3.1)
Где С — концентрация кислорода, П — порядок реакции, R — универсальная газовая постоянная, Е — Энергия активации.
При величине теплового эффекта реакции равным Q Скорость выделения тепла Qi Реагирующей со смесью составит:
48
Глава 3. Возникновение процессов горения
![]() (3.2)
(3.2)
Часть выделившегося тепла пойдет на нагревание смеси, а остальное тепло будет отводиться в окружающую среду. Количество отводимого тепла Q2 Равно:
![]() (3.3)
(3.3)
Где ![]() — коэффициент теплоотвода, S — Поверхность стенок сосуда, в котором заключена смесь.
— коэффициент теплоотвода, S — Поверхность стенок сосуда, в котором заключена смесь.
Для выяснения условий самовоспламенения рассмотрим Рис 3.1. На этом графике по горизонтальной оси отложена температура смеси, а по вертикальной — количество тепла, выделяющегося и отводимого в едини-цу времени. Три наклонных прямых ![]() Соответствуют трем значениям
Соответствуют трем значениям
Начальной температуры.
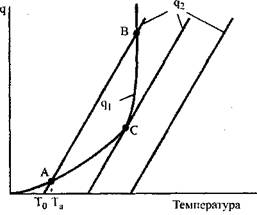
Рис. 3.1. Тепловыделение Qi И теплоотвод Q 2 при химической реакции Смеси в сосуде объемом V
При установившемся состоянии реагирующей смеси тепловыделе-ние от реакции Q1 Будет равно теплоотводу Q2. Соответствующая этому встоянию температура будет равна абсциссе точек пересечения кривых q1(T) и Q2(T). Из Рис. 3.1 Видно, что кривые тепловыделения и теплоотвода иногда пересекаются в двух точках, а иногда — в одной.
Рассмотрим первый случай — пересечение в двух точках. Смесь с начальной температурой Т0 За счет теплоты реакции будет нагреваться до
49
Корольченко А. Я. Процессы горения и взрыва
Равновесного состояния, отображаемого точкой С (при этом температура реагирующей смеси равна Та). Это состояние системы будет устойчивым, поскольку дальнейшее повышение температуры сопровождается превышением теплоотвода над тепловыделением. Вторая точка пересечения кривых В лежит в области более высоких температур и тепловой режим системы в этом случае будет неустойчивым. При отклонении от состояния, отвечающего точке В, система в прежнее состояние уже не возвратится, а будет все более отклоняться от него.
При увеличении начальной температуры стенок сосуда Т0 Прямая, характеризующая теплоотвод, будет смещаться вправо, а температура реагирующей смеси Та Будет непрерывно и плавно возрастать. При некоторой температуре Тсв Кривые Qi(T) И Q2(T) Соприкасаются (точка С), что физически означает равенство при этой температуре величин тепловыделения и теплоотвода. Точка С характеризует граничные условия существования стационарного режима. При незначительном повышении температуры стенки сосуда по сравнению с Тсв Тепловыделение будет превышать теплоотвод и произойдет резкое увеличение температуры реагирующей смеси.
Явление, заключающееся в переходе от медленно протекающей реакции, сопровождающейся незначительным разогревом, к бурному прогрессивно ускоряющемуся выгоранию смеси, называется самовоспламенением. В научной литературе его часто называют явлением «теплового взрыва».
Рассмотрим количественные соотношения, характеризующие про
цесс самовоспламенения газовых смесей. <
В точке касания кривых тепловыделения и теплоотвода величины Q
И q2, а также их производные по температуре равны. Таким образом, для
критического условия существования смеси можно записать: |
|
|
|
= a-(Ta-TeyS (3.4:. |
|
|
|
A—S. (3.5; |
Глава 3. Возникновение процессов горения
Разделив левые и правые части уравнений, получим:
|
|
Или
(3.6)
|
|
Отсюда
(3.7)
|
|
(3.8)
Температуре самовоспламенения в формуле (3.8) соответствует знак минус перед значением квадратного корня.
Установлено, что ![]() . Поэтому подкоренное выражение в
. Поэтому подкоренное выражение в
Формуле (3.8) можно заменить разложением в ряд и с достаточной точностью ограничиться тремя первыми членами разложения. Тогда получаем:
|
|
(3.9)
И окончательно:
|
|
(3.10)
|
|
Многочисленными экспериментами установлено, что величина • не превышает нескольких процентов от значения То. Поэтому, не делая заметной ошибки, можно принять:
![]()
С учетом этого, формула (3.5) может быть представлена в виде:
![]() (3.11)
(3.11)
Соотношение (3.11) устанавливает связь, между составом горючей смеси и величиной температуры самовоспламенения. Если принять поря-
51
Корольченко А. Я. Процессы горения и взрыва
Док реакции П = 2, то зависимость между С и Тсе Отражается кривой, показанной На Рис. 3.2 И ограничивающей область самовоспламеняющихся смесей.
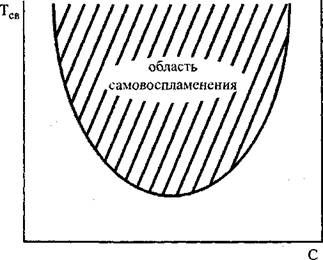
Рис. 3.2. Зависимость температуры самовоспламенения От состава смеси при постоянном давлении
Теория, в полном согласии с экспериментом, показывает, что не любая смесь горючего с окислителем может самовоспламениться. Самовоспламеняются лишь смеси, состав которых находится В Пределах соответствующих концентраций.
В настоящее время установлено, что при самовоспламенении могут преобладать тепловые, либо цепные процессы. При дальнейшем изложении мы ограничимся рассмотрением вопросов, относящихся к тепловой теории.
Величина температуры самовоспламенения зависит от химического строения веществ и находится в области достаточно высоких температур:
Вещество Температура
Самовоспламенения, °С
Метан 535
Этан 515
Пропан 465
52
Глава 3. Возникновение процессов горения
|
Бутан |
405 |
|
Пентан |
285 |
|
Гексан |
235 |
|
Этилен |
540 |
|
Аммиак |
650 |
|
Бензол |
535 |
|
Сероуглерод |
105 |



 4 мая, 2013
4 мая, 2013  admin
admin 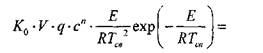
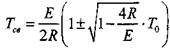
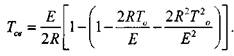
 Опубликовано в рубрике
Опубликовано в рубрике