В текущее время нефть и газ как природные источники энергии занимают главенствующее положение в энергетике многих государств. Совместно с тем, в странах, где это сырье отсутствует, употребляются разные виды органического горючего: уголь, торф, горючие сланцы, антрацит, лигниты, древесная порода, бытовые органические отходы. Данное горючее делает две функции:
- во-1-х, методом полного сжигания в котлах и промышленных печах реализуется его энергетический потенциал в виде теплоты и электроэнергии;
- во-2-х, многие виды органического горючего употребляются в качестве технологического сырья (к примеру, высокотемпературной переработкой получают металлургический кокс, ароматичные углеводороды, также высококалорийный искусственный газ, который является кандидатурой природному газу).
По методу производства различают природные и искусственные горючие газы. Природные газы добывают на промыслах газовых либо нефтегазовых месторождений. Промышленное значение получают также природные газы, добываемые на шахтах, разрабатывающих газоносные угольные пласты.
Искусственные горючие газы вырабатывают из углей, сланцев, кокса, древесной породы, торфа, биомассы и водянистого горючего на газовых заводах. К числу искусственных относятся также газы, получаемые в качестве побочных товаров основного производства. К примеру, при коксовании угля появляется коксовый газ, а в доменных печах при плавке стальных руд в итоге неполного сгорания в печи углерода кокса и других хим реакций — доменный газ.
Газификация углей, горючих сланцев и других видов органического горючего — это процесс полного перевоплощения горючей массы данных топлив в горючие газы при помощи воздуха, водяного пара, кислорода либо их консистенций при высочайшей температуре. Процесс газификации твердого горючего представляет собой совокупа окислительных и восстановительных процессов, в итоге которых органическое вещество начального горючего преобразуется в смесь газов, содержащую горючие составляющие (СО, Н2, СН4) и балластные примеси (СО,, N2, Н20).
Газификация осуществляется с целью перевоплощения многозольного низкосортного горючего в газовый энергоэлемент, применимый для отопления паровых котлов и промышленных печей различного предназначения либо с целью получения газовых консистенций для синтеза минеральных удобрений, спиртов либо синтетического водянистого горючего и других хим товаров. Газификация проводится в аппаратах, именуемых газогенераторами, работающих при атмосферном либо завышенном давлении. Главные продукты газификации сланца — газ, смола и газовый бензин.
Для тепловой переработки углей и сланцев с целью получения экологически незапятнанного газового энергоэлемента и ценной хим продукции могут быть применены технологии с применением высокотемпературных режимов, а именно пиролиза [1].
Основными факторами, влияющими на формирование товаров пиролиза, их состав и количественный выход, являются конечная температура, скорость нагрева частиц и среда, в какой происходит пиролиз. Состав среды может быть переменным. Высокоскоростной регулируемый пиролиз осуществим только при переработке сырья, размельченного до состояния пыли грубого помола.
Рекомендуемые режимы пиролиза для промышленной реализации:
- окислительный пиролиз — вкупе со сланцем в реактор поступает воздух в количестве 5-7 % от на теоретическом уровне нужного для полного сгорания;
- пиролиз в среде связанного окислителя, в потоке пара либо диоксида углерода С02;
- пиролиз с частичной рециркуляцией газа, т.е. в среде, содержащей кроме оксидов углерода также предельные и непредельные углеводороды, водород.
Разглядим особенности перечисленных режимов пиролиза [2]. Окислительный пиролиз
Воздух при подаче в газогенератор ведет взаимодействие с раскаленным слоем горючего и образует нестойкие пероксидные соединения. При температуре потока 250-300 °С кислород в газовой фазе потока отсутствует. Образовавшиеся перокси-ды — термически нестойки и при предстоящем повышении температуры распадаются на куски с наименьшей молекулярной массой. Скорость распада пероксидных соединений существенно превосходит скорость деструкции частиц неокисленных соединений. Таким макаром, скорость деструктивных перевоплощений органического вещества сланца резко возрастает, что интенсифицирует все следующие процессы перевоплощений сланца в конечные продукты. Жесткий углерод, соединяясь с кислородом воздуха, образует негорючее газообразное соединение — С02. При этой реакции выделяется огромное количество теплоты, и диоксид углерода греется до высочайшей температуры:
С + О2 = СО2 + 97 650 ккал (410 кДж).
Поднимаясь ввысь, СО, опять попадает на раскаленную поверхность угля, в итоге чего восстанавливается до оксида углерода (появляется горючий газ):
СО2 + С = 2СО — 38 790 ккал (160 кДж).
В безупречном случае горючий газ состоит из 34,7 % оксида углерода и 65,3 % азота:
2С + О2 + 3,76 N2 = 2СО + 3,76 N2 + + 58,860 ккал (250 кДж).
Этот газ употребляется в большей степени как сырье для процессов хим переработки, где желательна высочайшая концентрация оксида углерода.
При производстве горючего газа в зоне газификации при первой реакции выделяется больше теплоты, чем поглощается при 2-ой реакции, в конечном итоге выходит излишек теплоты, с помощью которого горючее в генераторе поддерживается в раскаленном состоянии. Под действием высочайшей температуры зола угля может перебегать в размягченное и даже жидкое состояние, потому в газогенераторах воздушного газа удаление шлака происходит, обычно, в водянистом (расплавленном) виде.
На базе окислительного пиролиза может быть создание высокопроизводительных аппаратов для тепловой переработки сланца.
Пиролиз в среде связанного окислителя (водяного пара либо диоксида углерода)
Ввод перерабатываемого горючего в реактор пиролиза может осуществ¬ляться с применением перегретого водяного пара либо, что существенно пореже, углекислого газа. Эти реаген¬ты содержат окислитель в химически связанном состоянии, их взаимодей¬ствие с продуктами распада нату¬рального сланца труднее и возмож¬но только при относительно больших температурах. Так, при температу¬ре потока выше 800 °С водяной пар реагирует с углеродом жестких ча¬стиц по эндотермической реакции (с поглощением теплоты):
Н20 + С = СО + Н2 — 28 380 ккал (120 кДж).
Как разбавитель, понижающий парциальное давление компонент системы, водяной пар содействует глубочайшему распаду высокомолекулярных соединений начального горючего на соединения с наименьшей молекулярной массой и, задерживая процессы ароматизации, увеличивает выход непредельных углеводородов в продуктах пиролиза.
В определенных критериях водяной пар способен каталитически окислять газообразные углеводороды и оксид углерода по реакциям:
СН4 + Н20 = СО + ЗН2;
СО + Н20 = С02 + Н2.
Для разложения водяного пара и образования горючих газов в газогенератор должно поступать дополнительное количество теплоты. Для этого процесс газификации производят временами. Сначала в газогенератор вдувают воздух, нужный для перевоплощения части углерода в диоксид углерода и разогрева горючего (фаза жаркого дутья), потом вдувают водяной пар для получения так именуемого водяного газа (фаза газования). В безупречном случае получаемый газ состоит из 50 % оксида углерода и 50 % водорода. Фактически водяной газ содержит некое количество азота, диоксида углерода и метана.
При газификации горючего, обеспечивающего большой выход летучих веществ, водяной газ обогащается газами сухой перегонки. Таковой газ именуется двойным водяным газом. Водяной и двойной водяной газы находят применение в индустрии хим синтеза и искусственного водянистого горючего, при производстве водорода, в качестве добавки к бытовому газу, также для сварки и резки металлов.
В связи с тем, что водяной пар активно ведет взаимодействие со всеми компонентами, образующимися при высокоскоростном пиролизе сланца, что сопровождается повышением выхода водорода и понижением содержания балластных компонент в газе, пиролиз в среде водяного пара целенаправлено использовать для получения газовых консистенций с данным соотношением Н2-СО, применяемых в качестве синтез-газов и восстановительных газов в металлургии.
При одновременной подаче в газогенератор воздуха и водяного пара протекают две реакции:
2С + О, + 3,76 N, = 2СО + 3,76 N2 + 58 860 ккал (250 кДж);
С + Н20 = СО + Н2 — 28 380 ккал (120 кДж).
При всем этом появляется смешанный генераторный газ. Количество водяного пара в паровоздушной консистенции, поступающей в газогенератор, регулируется таким макаром, чтоб избежать шлакования горючего. Потому что обозначенные реакции сопровождаются обратными термическими эффектами, то, изменяя содержание водяного пара в паровоздушной консистенции, можно регулировать температуру в газогенераторе.
Смешанный газ является главным видом энергетического газа и применяется в разных отраслях индустрии. Смешанный газ обычно именуют генераторным газом.
При подаче в газогенератор консистенции кислорода с паром появляется так именуемый парокислородный газ. Протекающие реакции те же, что и для смешанного газа. Процесс газификации осуществляется при обычном либо завышенном (2,0-2,5 МПа) давлении.
Применение парокислородного дутья в связи с отсутствием в нем азота дает возможность получать из низкосортных углей генераторные газы с завышенной теплотой сгорания.
При газификации горючего на парокислородном дутье при высочайшем давлении получают (после чистки от диоксида углерода) газ с удельной теплотой сгорания около 4000 ккал/м3 (18 кДж/м3).
Пиролиз с частичной рециркуляцией газа, получаемого в итоге высокоскоростного нагрева частиц горючего
Существенное количественное и высококачественное изменение выхода товаров пиролиза достигается методом рециркуляции части пиролизного газа для подачи пылевидного горючего в высокотемпературную зону реактора. Таковой режим высокоскоростного пиролиза можно именовать рецикуляционным. Он отличается от рассмотренных выше режимов тем, что первичные процессы деструкции органической массы сланца и вторичные реакции синтеза новых соединений протекают в газовой среде, основными компонента¬ми которой являются предельные и непредельные углеводороды, водород и оксид углерода.
При малой длительности контакта олефинов с жесткой фазой воздействие этих реакций на состав пиролизного газа невелико
В критериях скоростного пиролиза такие составляющие рециркуляционного газа, как Н2 и С02, фактически не реагируют с углеродом коксовых частиц и только углекислый газ, взаимодействуя при определенных температурных критериях с углеродом, может восстанавливаться до оксида углерода. Потому при частичной рециркуляции сухого отбензиненного газа газообразование (в реакторе) обосновано в главном реакциями теплового распада органического вещества сланца и вторичными превращениями первичных товаров деструкции. Общий выход газа при рециркуляционном режиме высокоскоростного пиролиза сланцев меньше, чем при режимах термоокислительного пиролиза. Отличаясь наименьшим содержанием балластных компонент и поболее высочайшим содержанием углеводородов, таковой газ подходящ для технологического использования, к примеру с целью извлечения этиленовых углеводородов.
Принципные особенности рассмотренных режимов высокоскоростного пиролиза горючих сланцев позволяют советовать термоокислительный пиролиз на воздушном дутье для получения топливного газа, пиролиз в среде водяного пара — для производства синтез-газов с данным соотношением СО-Н2, пиролиз с рециркуляцией — для совмещенного получения олефинов, бензольных углеводородов и гетероциклических соединений.
В табл. 1 приведен примерный состав получаемых генераторных газов (наименования газов даны по методу их получения).
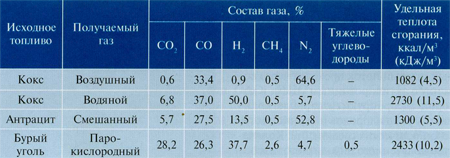
В Саратовском муниципальном техническом институте для исследования процессов пиролиза горючих сланцев, угля и определения критерий ведения процесса были сделаны экспериментальные стенды 2-ух типов: с трубчатым и циклонным реакторами (рис. 1, 2).
Было установлено, что при температуре потока на выходе из реактора, превосходящей 750 °С, происходит глубочайшая деструкция горючего с образованием низкомолекулярных летучих соединений.
После выхода товаров пиролиза из реактора улавливается и собирается пылевидный кокс, дальше в конденсационном устройстве водяной пар конденсируется и собирается в сборнике. Потом очищенный и охлажденный газовый поток проходит через колонку с активированным углем, в какой адсорбируются пары легкокипящих углеводородов и сернистых гетероциклических соединений. Количество приобретенного пиролизного газа определяют по показанию газового счетчика, при всем этом за время опыта отбирается средняя проба газа [4].
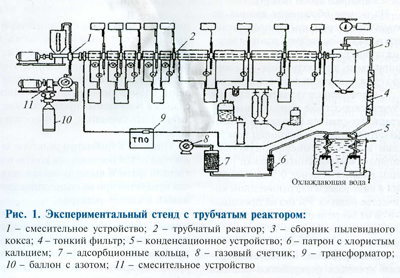
На базе обобщения данных по результатам серии опытов представляется вероятным избрать условия ведения процесса пиролиза, более подходящие для получения мотивированного продукта — газа либо газового бензина.
С применением обозначенных щитов исследован высокоскоростной пиролиз высоко-сернистых сланцев Поволжья. В опытах с трубчатым и циклонным реакторами в высокотемпературную зону аппарата размельченный сланец (частички размером наименее 0,5 мм) поступал в виде взвеси в ограниченном количестве воздуха. Расход не превосходил 5-8 % от на теоретическом уровне нужного для полного сгорания испытуемого горючего.
Таким макаром, исследуемый режим процесса переработки сланцев можно квалифицировать как окислительный пиролиз.
Особенность перевоплощения органического вещества твердого горючего при нагреве в среде, содержащей кислород, состоит в том, что в температурном интервале до 300 °С кислород интенсивно ведет взаимодействие с органическим веществом, образуя нестойкие соединения, которые при предстоящем повышении температуры скачкообразно распадаются, инициируя и интенсифицируя перевоплощение высокомолекулярного природного образования и органической массы горючего в низкомолекулярные соединения.
Механизм исходных стадий окислительного пиролиза, т.е. нрав взаимодействия кислорода (газа-носителя) с жестким топливом при высокоскоростном нагреве частиц до 300-350 °С таковой же, как при прямоточном движении газовзвеси и при движении в закрученном потоке в реакторе циклонного типа. Но условия развития первичных деструктивных перевоплощений горючего и вторичных стабилизационных процессов пиротехнического синтеза конечных товаров при использовании нареченных аппаратов различны, что оказывает влияние на рассредотачивание частей перерабатываемого сланца в получаемых продуктах окислительного пиролиза, на их состав и количество.
Пиролиз в трубчатом реакторе характеризуется неизменным контактом жесткой фазы и выделяющихся летучих товаров при их совместном движении в канале реактора.
Термический режим не стационарен, процесс первичных деструктивных перевоплощений нагреваемых частиц протекает в неизотермических критериях, время изотермического состояния потока в конце реактора в критериях проведенных опытов не превышало 0,1 с.
Другая картина наблюдается в реакторе циклонного типа. При тангенциальном вводе газовой взвеси частиц сланца в реактор под действием центробежной силы твердые частички оттесняются к стене реактора, а выделяющиеся при всем этом летучие продукты теплового разложения движутся в центральную часть реактора, откуда отводятся для предстоящей обработки.
Таким макаром, время контакта основной массы жестких частиц и парогазовых товаров в циклонном реакторе ограниченно, вкупе с тем летучие продукты более длительное время, чем в трубчатом реакторе, находятся под воздействием конечной температуры переработки. Это непременно благоприятно влияет на окончание стабилизационных процессов и синтез соединений, образование которых термодинамически более возможно при температуре в реакторе такового типа.
В газе, приобретенном в реакторах обоих типов, содержание оксидов углерода и их количественное соотношение приблизительно схожи (табл. 2), что обосновано более полной диссоциацией карбонатов кальция при повышении температуры потока (с образованием оксида кальция).
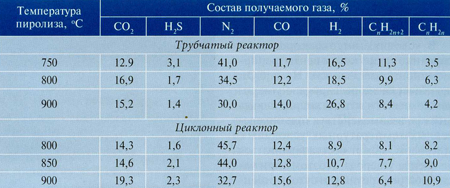
При совместном движении в канале реактора парогазовых товаров пиролиза и жесткой фазы сероводород реагирует с оксидом кальция, в итоге чего образуются сульфиды и значимая часть серы удерживается коксовым остатком.
Проведенный анализ указывает, что окислительный пиролиз высокосернистых сланцев Поволжья можно рассматривать как один из многообещающих вариантов технологии их переработки с внедрением реакторов циклонного типа [5].
Перечень литературы
- Булкатов А.Н., Мовсумзаде Э.М. Многообещающие технологии всеохватывающей энергохимической переработки жестких углеводородов // Хим и нефтегазовое машиностроение 2009. № 9. С. 21-23.
- Блохин А.И., Зарецкий М.И., Стельмах Г.П., Эйвазов Т.С. Новые технологии переработки высокосернистых сланцев. М.: Светлый стан, 2001.
- Каширский В.Г. Тепловая переработка горючих сланцев и их энерготехнологическое внедрение. Саратов: Изд-во Саратовского ГТУ. 2001.
- Каширский В.Г. Экспериментальные базы всеохватывающего энерготехнологического использования топлив. Саратов: Изд-во Саратовского ГТУ. 1999.
- Каширский В.Г., Атоян Э.М. Всеохватывающее внедрение многосернистых сланцев СССР (направленный на определенную тематику обзор). М.: ЦНИИТЭнефтехим, 1985.



 27 августа, 2014
27 августа, 2014  Inzhener
Inzhener  Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: