Основным горючим компонентом топлива является, как известно, углерод. Теплота сгорания 1 кг-атома углерода в виде графита равна ОКОЛО
94 ООО ккал [46], т. е. около 7830 ккал/кг.
При сгорании углерода в воздухе по уравнению
С + 02 + 3,76 N3 = СОа + 4,76 N2
На каждый килограмм углерода образуется 1,87 нм3 С02 и 7,03 нм3 N2- Отсюда жаропроизводительность углерода, подсчитанная по формуле (VIII.3), равна 2175°.
При сжигании углерода во влажном воздухе с содержанием одного процента влаги по массе жаропроизводительность углерода равна около 2145°.
Если принять, по Менделееву, теплоту сгорания углерода в твердом и жидком топливе равной 8100 ккал/кг, то жаропроизводительность углерода при сжигании в сухом воздухе равна около 2240°, а с учетом влажности воздуха — около 2200°.
Теплота сгорания (низшая) газообразного молекулярного водорода равна 57 740 ккал/молъ, или 28 640 ккал/кг, или 2576 ккал/нм3 [38].
При сгорании 1 нм3 водорода в сухом воздухе согласно уравнению
2 Н2 + 02 + 3,76 N5, = 2Н20 + 3,76 К2
Образуются продукты сгорания, состоящие из 1 нм3 водяного пара и 1,88 нм3 азота.
Жаропроизводительность водорода при сжигании в сухом воздухе равна 2235°, а при сжигании в воздухе, содержащем 1% влаги, около 2200°.
Таким образом, несмотря на большое различие в теплотах сгорания, жа — ропроизводительности углерода и газообразного молекулярного водорода весьма близки.
Закономерность этого положения отчетливо выявляется при сопоставлении отношений теплоты сгорания и объемов продуктов сгорания углерода и водорода в теоретически необходимом количестве воздуха (табл. 29).
Таблица 29
Отношения теплоты сгорания ‘я теоретических объемов продуктов сгорания
|
Топлиио |
Теплота сгорания Уц |
‘ой. |
Объем продуктов сгорания Л |
Унг |
|
Углерод (графит) |
94 000 ккал/кг-атпом |
106,8 им3/кг-атом |
||
|
Водород |
57 740 ккал/моль |
1,54 |
04,5 нм31 к г-моль |
1, |
Теплота сгорания 1 кг-атома углерода превышает теплоту сгорания (низшую) 1 кг/моль газообразного водорода в 1,64 раза, а теоретический объем продуктов сгорания 1 кг-атома углерода почти во столько же раз превышает объем продуктов сгорания {кг/моль водорода (в 1,65 раза). Отсюда ясно, что с учетом близкой объемной теплоемкости продуктов сгорания углерода и водорода в теоретически необходимом объеме воздуха жаропроизводительно — сти углерода и газообразного водорода мало отличаются, несмотря на большое различие в теплоте сгорания углерода и водорода.
Д. И. Менделеев подсчитал жаропроизводительность водорода с высшей теплотой сгорания 30 ООО ккал/кг и указал, что если бы существовал твердый
Водород ((}ъ около 30 ООО), то и он, сгорая в воздухе, дал бы более низкую-
Температуру, чем углерод.
Если бы высшая теплота сгорания водорода равнялась 30 000 ккал/кг и низшая теплота сгорания 24 600 ккал/кг, то жаропроизводительность водорода, подсчитанная по современным значениям теплоемкости продуктов сгорания, равнялась бы примерно 1945° при сжигании в сухом воздухе и — 1915° при сжигании во влажном воздухе, содержащем 1% Н20 (по весу).
Жидкое нефтяное топливо, а также природные, нефтезаводские и сжиженные газы состоят в основном из углеводородов. Поскольку жаропроизво- дительности водорода и углерода близки между собой, создаются предпосылки для того, чтобы жаропроизводительности различных углеводородов также не отличались сколько-нибудь существенно от жаропроизводительности углерода и водорода.
Однако жаропроизводительность углеводородов не определяется однозначно лишь жаропроизводительностью углерода и водорода, так как на нее оказывает определенное влияние теплота разрыва связей между атомами в молекулах углеводородов различного строения и молекулярного веса.
Влияние теплот разрыва связей в молекулах углеводородов на их теплоту сгорания было рассмотрено в гл. IV. Аналогичным образом влияет теплота разрыва связей между атомами и на жаропроизводительность углеводородного топлива.
Если расщепление молекул углеводородов с образованием углерода и молекулярного водорода является эндотермическим процессом, как это имеет место у алканов и особенно отчетливо выражено у метана, то жаропроизво- дительность углеводородов соответственно ниже жаропроизводительности
Углерода и водорода. Если же рассматриваемый процесс является экзотермическим и сопровождается выделением значительного количества тепла, как у непредельных углеводородов, например у этилена и в особенности у ацетилена, то жаропроизводительность углеводородов превышает жаропроизво — дительность углерода и водорода.
Различия в жаропроизводительности особенно значительны у первых членов различных гомологических рядов. С увеличением молекулярного веса углеводородов и возрастанием в молекулах числа так называемых групп гомологической разнос™ «СН2» различия в жаропроизводительности алка- нов, алкенов, алкинов и ароматических углеводородов и цикланов сглаживаются и жаропроизводительности всех углеводородов асимптотически приближаются примерно к 2140°, т. е. к жаропроизводительности цикланов, молекулы которых состоят только из групп СН2 [6].
Рис. 6 наглядно иллюстрирует указанное положение. С увеличением молекулярного веса и числа групп гомологической разности «СН2» в молекуле жаропроизводительность алканов возрастает с 2043° у метана до 2132* у эйкозана (С20Н42), жаропроизводительность алкенов снижается с 2284" у этеиа (этилена) до 2151° у эйкозена (С20Н40), а жаропроизводительность алкинов с 2620° у этина (ацетилена) до 2167° у эйкозина (С20Н38).
Углеводороды различных гомологических рядов (в парообразном состоянии) имеют следующие значения жаропроизводительности (°С) при сгорании в абсолютно сухом воздухе:
|
Алканы (СлН2п+2) |
ІІентнн (СьНз) |
2300 |
|
|
Метан (СНі) |
2043 |
Гексин (СсНщ) |
2275 |
|
Этап (СгНо) |
2097 |
Гсптіш (С7Н;;’! |
2250 |
|
Пропан (С3Н8) |
2110 |
Октііи (С8Нп) |
2235 |
|
Бутан (СіШо) |
2118 |
Децші (CioHis) |
2213 |
|
ІІентан (С^їїіг) |
2119 |
Пеитадеции (Сі. Д |
2,180 |
|
Гексан (СсНц) |
2124 |
Оіікозіш (Csollas) |
2167 |
|
Октан (С8Н]§) |
2128 |
Ароматическ углевидо,]к ( 2ті.—6^ |
|
|
Декан (СмНм) . |
2І29 |
||
|
Пентадекан (Сі5]Ь-. |
2132 |
Беизол (СеН.) |
2258 |
|
Зіікозап (СгоНі>) |
2132 |
||
|
Толуол (С7Нв) |
22И |
||
|
Алкеиы (СПН2П) |
Ксилол (Сзіїю) |
>,203 |
|
|
Этен (СгП-і) |
2284 |
Пропилбопзол (C., |
,:197 |
|
Пропен (СзНй) |
2224 |
Цимол (СюНі.) |
2188 |
|
Бутен (Сіїї8) |
2203 |
Феишшоиаи (СюІ. Іг ) |
2171 |
|
Пентен (СаНіо) |
2189 |
Фсиплтотрадекаи (С» ЛЬ |
2,160 |
|
Децен (СіоНао) . ІІентадеден (СиїЬі’/ |
2164 2153 |
Циклат,! (СпН2м) |
2153 |
|
Эйкозен (СгоШо) |
2151 |
Циклопентан (С,-,Нш) . |
|
|
Мегіїдциклоцспгаи (СлПіа) |
2149 |
||
|
Ллкини (СПП2„_2) |
Эгллциклопентан (С71Іі■) |
2145 |
|
|
Этпн (СгНг) |
2620 |
ІІроцилциклопоитаи (Celli ) |
2144 |
|
Проппн (СзНл) |
2420 |
Амилциклопентан (СюШо) |
2144 |
|
Бутпн (СЛо) |
2340 |
Цпклопентплдскип (Сі;,ІІзо) |
2140 |
Сближение жаропроизводительности насыщенных и ненасыщенных углеводородов с увеличением числа атомов углерода в молекуле показано на рис. 6.
Рис. 7 иллюстрирует практически постоянную жаропроизводительность насыщенных углеводородов — алканов при резком увеличении их объемной теплоты сгорания.
Жаропроизводительности углеводородов нормального строения и различных изомеров весьма близки между собой вследствие малого значения теплоты изомеризации по сравнению с теплотой сгооагия. Так, различия в жа-
|
|
|
|
|
|
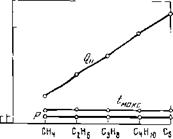
Рис. Жаропропзкодитслыюсть углеводородов различных гомологических рпдов
1 — алкшхсш; 4 — цинланов;
2 — ароматических углеводородов; 5 — алканов
3 — алкспов;
Рис. Теплота сгорании и жаропроизводительность уГЛеВОДОрОДОП
С,)и — низшая темплота сгорали«;
Р — то же, отнесенная к 1 нм9 сухих продуктов горения;
Сс — жаропроизнодитслшюсть
Ропроиэводитсльности нормального октана и шестнадцати изооктанов раз — личного строения не превышают 6°, т. е. 0,3%.
Жаропроизводительность углеводородов в парообразном состоянии выше, чем г, жидком, примерно на 15°, или па 0,8%. В свою очередь жаропроизво — дптелыюсть углеводородов в жидком состоянии несколько больше жаро- производительпости твердых углеводородов вследствие затраты тепла на плавление углеводородов.
Замена атома водорода в углеводородной молекуле на гидроксил (ОН) или карбоксил (СООН), т. с. образование из углеводородов спиртов или органических кислот резко снижает теплоту сгорания вследствие уменьшения процентного содержания в горючем углерода и водорода и дополнительно к этому ввиду частичного окисления С И Н (см. гл. II).
Так, теплота сгорания метилового спирта СН30Н (или СН40) составляет всего лишь 43% от теплоты сгорания метана СН4.
При столь большом различии в теплотах сгорания жаропроизводитель — ности СП4 и С1140 практически совпадают. Объясняется этот на первый иаг.’м’д неожиданный факт тем, что при внедрении кислорода в состав горючей массы топлива соответственно снижается потребность в кислороде воздуха для сгорания топлива, что обусловливает меньшее поступление азота воздуха.1 продукты сгорания и, следовательно, уменьшение их объема. Поэтому жаронронзводительность может практически не меняться, как это имеет место прп замене водорода гидроксилом, или лишь незначительно снижается при замене атома водорода карбоксильной группой [6]. Кривые на рис. 8 и А иллюстрируют указанное положение.
Горючая масса дров и торфа с высоким содержанием кислорода обладает теплотой сгорания, значительно более низкой, чем горючая масса антрацита или каменного угля. Однако различие в жаропронзводительпости указанных видов топлива существенно меньше. Так, теплота сгорания горючей массы дров па 44% меньше, чем антрацита, а жаропроизводительность горючей массы ниже лишь на 9%.
Более сложный характер имеет сопоставление теплот сгорания и жаропроизводительпости углерода и окиси углерода. Теплота сгорания 1 кг-атома углерода в виде графита равна около 94 ООО ккал, а 1 моля окиси углерода — лишь около 08 ООО ккал. Тем не менее жаропроизводительность окиси углерода
|
Углеводородов и спиртов |
|
— жаропроиэводительность углеводородов 1тах; 4 ————— ТО же спиртой |
|
Рис. 8. Теплота сгорания и исаропроизводитсльность 1 — низшая теплота сгорания ()я углеводородов; 3 г — то же спиртов; |
|
|||
|
|||
|
|
||
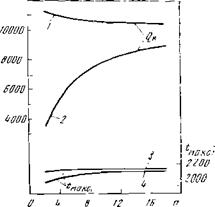
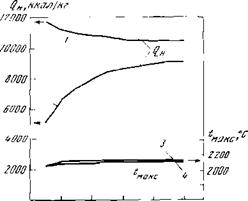
Рис. 9. Теплота сгорания и жаропроиэводительность
1 — низшая теплота сгорания углеводородов;
2 — то же. органических кислот;
Углеводородов и органических кислот
3 — жаропроиэводительность углеводородов;
4 — то же, органических; нислот
Равна 2370°, т. е. почти на 200° выше жаропроизводительности графита (2175°).
Указанное положение обусловлено тем, ЧТО присоединение К углероду первого атома кислорода связано с большой затратой энергии на разрыв связей между атомами углерода в графите. Вследствие этого из 94 ООО ккал потенциального тепла 1 кг-атома углерода лишь около 26 ООО ккал, т. е. менее 30%, выделяется в результате присоединения первого атома кислорода и образования окиси углерода. Присоединение же второго атома кислорода С окислением СО до С02 сопровождается выделением 68 ООО ккал тепла
С ■+ 0,502 ■+ 1,88 К2 = СО + 1,85 N2 26ООО ккал/кг-атом (VIII.4а) ^ СО + 0,5 Оа -р 1,88 N2 = С02 1,Ь8 N2 -(- 68000 ккая/молъ (VIII.46)
С -1- 0а 4- 3,76 ]Мг = С02 3,76 N2 + 94000 ккал/кг-атом (УШ.4в)
В результате при горении графита по уравнению (УШ.4в) на 1 моль
Продуктов сгорания выделяется около 20 ООО ккал (94 000 4,76), а при горении СО по уравнению (VIII.46) на 1 моль продуктов сгорания выделяется около 23 500 ккал (68 000 2,88), т. е. значительно больше тепла. Этим и об-
Ясняется, что максимальная температура нагрева продуктов сгорания СО, т. е. жаропроиэводительность окиси углерода, значительно выше жаропроизводительности графита.
Таким образом, горючая масса всех видов топлива — от антрацита и кокса до дров и торфа — с различным содержанием кислорода и различной теплотой сгорания характеризуется высокой жаропроизводительностью по-
Рядка 2000—2200°.



 11 июня, 2013
11 июня, 2013  admin
admin 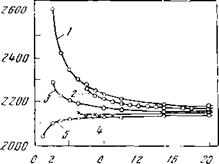
 Опубликовано в рубрике
Опубликовано в рубрике